L’epossido di cloro o Cl2O7 è un composto altamente esplosivo e reattivo. Può decomporsi violentemente a contatto con la materia organica ed è un potente agente ossidante utilizzato nella sintesi e nell’analisi chimica.
| Nome IUPAC | Epossido di cloro |
| Formula molecolare | Cl2O7 |
| numero CAS | 12015-53-1 |
| Sinonimi | Anidride perclorica, dicloro eptossido, cloro (VII) ossido, ossido di cloro, percloril perclorato |
| InChI | InChI=1S/Cl2O7/c2-1(3,4,5,6)10-7(8,9)11-12-13-14-10 |
Massa molare dell’epossido di cloro
L’epossido di cloro, formula chimica Cl2O7, ha una massa molare di 182,9 g/mol. Questo composto è costituito da due atomi di cloro e sette atomi di ossigeno, che lo rendono un agente altamente ossidante. La massa molare dell’epossido di cloro viene utilizzata per calcolare la quantità di sostanza in una determinata massa o volume di un campione utilizzando la costante di Avogadro.
Punto di ebollizione dell’epossido di cloro
L’epossido di cloro è un solido da incolore a giallastro, altamente reattivo e volatile. Il punto di ebollizione dell’epossido di cloro non è ben definito poiché si decompone prima di raggiungere il punto di ebollizione. L’epossido di cloro è un potente agente ossidante che può reagire con la materia organica, l’acqua e altre sostanze per formare composti esplosivi.
Punto di fusione dell’epossido di cloro
L’epossido di cloro ha un punto di fusione di -96°C (-141°F), che lo rende un solido a basso punto di fusione. L’epossido di cloro può esistere come liquido giallastro a temperatura ambiente a causa del suo basso punto di fusione e dell’elevata reattività. È importante maneggiare con cura l’epossido di cloro poiché può causare gravi ustioni ed è un forte agente ossidante.
Densità dell’epossido di cloro g/ml
La densità dell’epossido di cloro è 2,48 g/mL a temperatura ambiente. L’elevata densità dell’epossido di cloro lo rende un liquido denso che può rapidamente depositarsi sul fondo di un contenitore. L’elevata densità e reattività dell’epossido di cloro lo rendono un composto difficile da maneggiare e richiede speciali precauzioni di sicurezza se utilizzato nella sintesi chimica o nell’analisi.
Peso molecolare dell’epossido di cloro
Il peso molecolare dell’epossido di cloro, noto anche come massa molecolare relativa, è 182,9 g/mol. Il peso molecolare dell’epossido di cloro è importante nei calcoli chimici che coinvolgono la quantità di sostanza, massa e volume. L’elevato peso molecolare dell’epossido di cloro lo rende un composto denso e volatile che richiede un’attenta manipolazione e conservazione.
Struttura dell’epossido di cloro
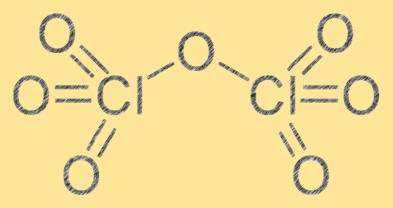
La struttura dell’epossido di cloro è composta da due atomi di cloro e sette atomi di ossigeno. Ha una formula molecolare di Cl2O7 e la sua geometria molecolare è una forma ottaedrica distorta a causa della repulsione tra gli atomi di ossigeno. L’epossido di cloro è un forte agente ossidante e può reagire con varie sostanze organiche e inorganiche. La struttura dell’epossido di cloro è essenziale per comprenderne le proprietà chimiche e il suo comportamento nelle diverse reazioni.
Formula dell’epossido di cloro
La formula chimica dell’epossido di cloro è Cl2O7. La formula indica che ciascuna molecola di eptossido di cloro contiene due atomi di cloro e sette atomi di ossigeno. La formula viene utilizzata per calcolare la stechiometria delle reazioni chimiche che coinvolgono l’epossido di cloro. La formula dell’epossido di cloro è importante anche per determinarne il peso molecolare, la densità e altre proprietà fisiche e chimiche.
| Aspetto | Solido da incolore a giallastro |
| Peso specifico | 2,48 a 25°C |
| Colore | Da incolore a giallastro |
| Odore | Piccante, acido |
| Massa molare | 182,9 g/mole |
| Densità | 2,48 g/ml a 25°C |
| Punto di fusione | -96°C (-141°F) |
| Punto di ebollizione | Si decompone prima del punto di ebollizione |
| Punto flash | Non applicabile |
| solubilità in acqua | Reagisce violentemente con l’acqua |
| Solubilità | Solubile in solventi organici |
| Pressione del vapore | Non disponibile |
| Densità del vapore | Non disponibile |
| pKa | Non disponibile |
| pH | Non applicabile |
Sicurezza e pericoli dell’epossido di cloro
L’epossido di cloro è un composto altamente reattivo e pericoloso che comporta notevoli rischi per la sicurezza se non maneggiato correttamente. In caso di contatto può causare gravi ustioni e danni agli occhi, alla pelle e al sistema respiratorio. L’epossido di cloro può anche reagire violentemente con l’acqua e i materiali organici, provocando esplosioni e pericoli di incendio. È essenziale utilizzare dispositivi di protezione individuale adeguati, inclusi guanti, occhiali e respiratori quando si maneggia l’epossido di cloro. Il composto deve essere conservato e trasportato in un contenitore sicuro e ben chiuso, lontano da fonti di ignizione, calore o umidità. È necessario seguire procedure di manipolazione e precauzioni di sicurezza adeguate per ridurre al minimo i rischi associati all’epossido di cloro.
| Simboli di pericolo | Agente ossidante, corrosivo |
| Descrizione della sicurezza | Evitare il contatto con acqua, acidi, materiali organici e agenti riducenti. Utilizzare adeguati dispositivi di protezione individuale. Conservare in un contenitore ermeticamente chiuso lontano da fonti di calore, umidità e fonti di ignizione. In caso di contatto con gli occhi, la pelle o le vie respiratorie, consultare immediatamente un medico. |
| Numeri di identificazione delle Nazioni Unite | ONU 3083 |
| Codice SA | 28299090 |
| Classe di pericolo | 5.1 (Materiali ossidanti) |
| Gruppo di imballaggio | II |
| Tossicità | Molto tossico per inalazione, ingestione o assorbimento cutaneo. Provoca gravi ustioni e danni ai tessuti. Può provocare esplosioni e pericoli di incendio a contatto con acqua, materiali organici e altre sostanze reattive. |
Metodi per la sintesi del cloro eptossido
L’epossido di cloro è un composto altamente reattivo e difficile da sintetizzare.
Uno dei metodi più comuni per sintetizzare l’epossido di cloro è la reazione del cloro gassoso e dell’ozono. Questa reazione è esotermica e può portare a una reazione esplosiva se non attentamente controllata.
Un altro metodo prevede la reazione del cloro gassoso con clorato di potassio, che produce eptossido di cloro e cloruro di potassio come sottoprodotti. Questo metodo richiede anche un attento controllo delle condizioni di reazione per prevenire la formazione di intermedi esplosivi.
L’epossido di cloro può essere sintetizzato facendo reagire il gas di cloro con il pentossido di dicloro, che produce eptossido di cloro e esossido di dicloro come sottoprodotti. Tuttavia, i ricercatori non utilizzano comunemente questo metodo a causa della natura pericolosa del pentossido di dicloro.
Altri metodi per sintetizzare l’epossido di cloro includono la reazione del cloro gassoso con vari composti organici, come benzene o toluene, in condizioni controllate. Tuttavia, questi metodi richiedono un’attenta ottimizzazione delle condizioni di reazione e non sono affidabili o comunemente usati come i metodi cloro-ozono o cloro-clorato di potassio.
Nel complesso, la sintesi dell’epossido di cloro richiede un attento controllo delle condizioni di reazione e presenta notevoli rischi per la sicurezza a causa della natura altamente reattiva del composto. È necessario seguire le precauzioni di sicurezza e le procedure di manipolazione adeguate quando si lavora con eptossido di cloro o altre sostanze pericolose.
Usi dell’epossido di cloro
- Cl2O7 trova il suo utilizzo principale come agente ossidante nella sintesi chimica e nella ricerca.
- Agisce come un potente ossidante, reagendo con un’ampia gamma di composti organici e inorganici, rendendolo utile in molte reazioni chimiche.
- Uno degli usi più comuni di Cl2O7 è la produzione di biossido di cloro, un potente disinfettante e agente sbiancante utilizzato nel trattamento delle acque, nella produzione di pasta di legno e carta e nella produzione tessile.
- Viene anche utilizzato come potente ossidante nella sintesi di numerosi composti organici, inclusi prodotti farmaceutici e agrochimici.
- Cl2O7 è utilizzato nel mondo accademico e nella ricerca per studiare la reattività di vari composti organici e inorganici. Serve anche come catalizzatore nella sintesi di alcuni composti, come le resine epossidiche e l’anidride acetica.
- A causa della sua natura pericolosa, le applicazioni industriali su larga scala generalmente non utilizzano Cl2O7. Richiede un’attenta manipolazione e stoccaggio per evitare la formazione di sostanze intermedie esplosive e altri rischi per la sicurezza.
Nel complesso, Cl2O7 è un composto utile nella sintesi chimica e nella ricerca, ma richiede precauzioni di sicurezza e procedure di manipolazione adeguate per ridurre al minimo i rischi associati al suo utilizzo.
Domande:
D: Cos’è Cl2O7?
R: Cl2O7 è un composto chimico composto da due atomi di cloro e sette atomi di ossigeno, con la formula chimica Cl2O7.
D: Qual è il nome corretto per Cl2O7?
R: Il nome corretto per Cl2O7 è dicloroepossido.
D: Cl2O7 è ionico o covalente?
R: Cl2O7 è un composto covalente. È composto da due elementi non metallici, cloro e ossigeno, e forma un composto molecolare attraverso la condivisione di elettroni tra atomi.
D: Quale ossido di seguito reagisce con l’acqua per formare un acido debole? MgO, Cl2O7, P4O10, Bi2O3, N2O5.
R: L’ossido che reagisce con l’acqua per formare un acido debole è N2O5. Quando N2O5 reagisce con l’acqua, forma acido nitrico, che è un acido debole. Gli altri ossidi elencati, MgO, P4O10, Bi2O3 e Cl2O7, non reagiscono con l’acqua per formare acidi deboli.
