Il disolfuro di carbonio è un composto chimico volatile formato combinando carbonio e zolfo. Viene utilizzato nei processi industriali, nella produzione di solventi e di fibre di rayon.
| Nome IUPAC | Disolfuro di carbonio |
| Formula molecolare | CS2 |
| numero CAS | 75-15-0 |
| Sinonimi | Disolfuro di carbonio, ditiocarb, disolfuro di carbonio |
| InChI | InChI=1S/CS2/c2-1-3 |
Proprietà del disolfuro di carbonio
Formula del disolfuro di carbonio
La formula chimica del disolfuro di carbonio è CS2. È costituito da un atomo di carbonio e due atomi di zolfo, legati insieme in una disposizione lineare. Questa semplice formula è essenziale per comprendere la composizione base del composto.
Massa molare del disolfuro di carbonio
La massa molare del disolfuro di carbonio è di circa 76,14 g/mol. Per calcolarlo, aggiungiamo le masse atomiche di un atomo di carbonio (12,01 g/mol) e due atomi di zolfo (32,06 g/mol ciascuno). Conoscere la massa molare aiuta con vari calcoli chimici.
Punto di ebollizione del solfuro di carbonio
Il disolfuro di carbonio ha un punto di ebollizione relativamente basso di circa 46,3°C (115,3°F). Questa proprietà lo rende volatile e facilmente vaporizzabile. Il suo basso punto di ebollizione è importante nei processi industriali e nelle applicazioni che richiedono una rapida evaporazione.
Punto di fusione del solfuro di carbonio
Il punto di fusione del disolfuro di carbonio è di circa -110,8°C (-187,4°F). Rimane allo stato solido a temperature inferiori a questo punto e passa allo stato liquido quando riscaldato. Comprendere il suo punto di fusione è fondamentale per la manipolazione e lo stoccaggio.
Densità del disolfuro di carbonio g/mL
La densità del disolfuro di carbonio è di circa 1,26 g/mL a temperatura ambiente. Questo valore indica la sua massa per unità di volume. Essendo più denso dell’acqua, affonderà quando miscelato e la sua densità influenzerà la sua solubilità in vari solventi.
Peso molecolare del disolfuro di carbonio
Il peso molecolare del disolfuro di carbonio è di circa 76,14 g/mol, calcolato dalla sua formula chimica. Questo valore gioca un ruolo essenziale nella stechiometria e nel determinare la quantità di composto nelle reazioni chimiche.
Struttura del disolfuro di carbonio
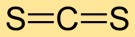
Il disolfuro di carbonio ha una struttura molecolare lineare, con l’atomo di carbonio al centro e gli atomi di zolfo su entrambi i lati. Questa semplice disposizione è fondamentale per comprenderne il comportamento chimico e le interazioni con altre sostanze.
Solubilità del disolfuro di carbonio
Il disolfuro di carbonio è scarsamente solubile in acqua, con solo circa 0,2 g per 100 ml di acqua a temperatura ambiente. Tuttavia, è molto solubile in solventi organici come benzene ed etanolo. Questo comportamento di solubilità è essenziale per varie applicazioni in chimica e nell’industria.
| Aspetto | Liquido incolore |
| Peso specifico | 1.26 |
| Colore | Incolore |
| Odore | Aroma pungente e dolce |
| Massa molare | 76,14 g/mole |
| Densità | 1,26 g/ml |
| Punto di fusione | -110,8°C (-187,4°F) |
| Punto di ebollizione | 46,3°C (115,3°F) |
| Punto flash | -30°C (-22°F) |
| solubilità in acqua | 0,2 g/100 ml (20°C) |
| Solubilità | Solubile in solventi organici come benzene ed etanolo |
| Pressione del vapore | 318 mmHg (20°C) |
| Densità del vapore | 2,62 (aria = 1) |
| pKa | ~ -2 |
| pH | Neutro (pH 7) |
Sicurezza e pericoli del disolfuro di carbonio
Il disolfuro di carbonio comporta notevoli rischi per la sicurezza. È altamente infiammabile e i suoi vapori possono formare miscele esplosive nell’aria. L’esposizione prolungata può provocare vertigini, mal di testa e perfino perdita di coscienza. È anche dannoso per la vita acquatica e l’ambiente. Una ventilazione adeguata, dispositivi di protezione individuale e uno stoccaggio ignifugo sono essenziali per ridurre al minimo i rischi. Evitare il contatto con la pelle e gli occhi poiché ciò potrebbe causare irritazioni e danni. La manipolazione dovrebbe avvenire in ambienti ben controllati e le fuoriuscite dovrebbero essere contenute rapidamente. Comprendere e seguire le istruzioni di sicurezza è essenziale per prevenire incidenti e garantire un ambiente di lavoro sicuro quando si maneggia il solfuro di carbonio.
| Simboli di pericolo | Infiammabile, nocivo |
| Descrizione della sicurezza | Liquido e vapori altamente infiammabili. Nocivo se inalato o ingerito. Provoca irritazione alla pelle e agli occhi. |
| Numeri di identificazione delle Nazioni Unite | UN1131 |
| Codice SA | 2813.10.1000 |
| Classe di pericolo | 3 (Liquidi infiammabili) |
| Gruppo di imballaggio | II (Pericolo medio) |
| Tossicità | Tossicità moderata |
Metodi per la sintesi del solfuro di carbonio
Diversi metodi attivi consentono la sintesi del disolfuro di carbonio.
Un metodo comune prevede la reazione dello zolfo con metano o gas naturale ad alte temperature, producendo CS2 come prodotto.
Un altro approccio consiste nel far reagire i vapori di zolfo con il carbone caldo. Inoltre, la combinazione di monossido di carbonio e vapore di zolfo su un catalizzatore può anche produrre disolfuro di carbonio.
Inoltre, la sintesi diretta di CS2 può verificarsi quando il carbonio reagisce con i vapori di zolfo a temperature elevate. In laboratorio, i chimici utilizzano la reazione tra xantato di potassio e acido solforico per la produzione su scala ridotta di disolfuro di carbonio.
Ciascun metodo richiede adeguate precauzioni di sicurezza a causa della natura altamente infiammabile e tossica del disolfuro di carbonio. La versatilità di questi metodi di sintesi consente varie applicazioni industriali, compreso il loro utilizzo come solvente, come materia prima nei processi chimici e nella produzione di fibre di rayon.
Usi del solfuro di carbonio
Il disolfuro di carbonio trova varie applicazioni grazie alle sue proprietà versatili. Ecco alcuni dei suoi usi:
- Applicazioni di ricerca e di laboratorio: i laboratori utilizzano il disolfuro di carbonio come reagente per varie reazioni chimiche, inclusa la sintesi di composti organometallici.
- Estrazione degli oli essenziali: Il solfuro di carbonio trova applicazione nell’estrazione degli oli essenziali dalle piante, facilitando la separazione dei composti aromatici desiderati.
- Estrazione dell’olio: le industrie utilizzano il disolfuro di carbonio per estrarre oli da semi e verdure grazie alla sua solubilità e al basso punto di ebollizione.
- Produzione di fibre di rayon: il disolfuro di carbonio svolge un ruolo vitale nella produzione di fibre di rayon perché aiuta a dissolvere la cellulosa, che i produttori poi estrudono per formare fibre sintetiche utilizzate nei tessili.
- Applicazioni industriali: il disolfuro di carbonio contribuisce alla produzione di pesticidi, fumiganti e prodotti chimici per la gomma. Inoltre, agisce come catalizzatore nella produzione di acido solforico e tetracloruro di carbonio.
- Solvente: il disolfuro di carbonio funge da solvente per una varietà di sostanze, inclusi oli, grassi, gomma, resine e zolfo. Di conseguenza, è comunemente utilizzato nella produzione di prodotti a base di cellulosa.
- Processi chimici: serve come materia prima nella sintesi di composti organici come tetracloruro di carbonio, tiocarbammati e ditiocarbammati. Questi composti trovano applicazioni nell’industria agricola e farmaceutica.
- Vulcanizzazione della gomma: il disolfuro di carbonio partecipa al processo di vulcanizzazione della gomma, migliorandone la resistenza, l’elasticità e la resistenza all’usura.
Queste diverse applicazioni evidenziano l’importanza del disolfuro di carbonio in molteplici settori, che vanno dal tessile e dall’agricoltura alla ricerca e alla produzione.
Domande:
D: Quale delle seguenti molecole è polare? A. ammoniaca B. ottano c. acqua d. disolfuro di carbonio
R: a, L’acqua (H2O) è polare a causa della sua forma molecolare curva e della condivisione ineguale degli elettroni.
D: Qual è l’angolo tra i legami carbonio-zolfo nella molecola di disolfuro di carbonio (CS2)?
R: L’angolo tra i legami carbonio-zolfo nel CS2 è di 180 gradi, formando una geometria lineare.
D: Quanti atomi totali ci sono in 1 mole di disolfuro di carbonio?
R: Una mole di disolfuro di carbonio contiene 6,02 x 10^23 molecole e ciascuna molecola ha 3 atomi (1 di carbonio e 2 di zolfo).
D: Quale di questi elementi pensi che sarebbe solubile nel solvente non polare, il disolfuro di carbonio, CS2?
R: Le sostanze non polari come l’ottano (b) dovrebbero essere solubili nel disolfuro di carbonio (CS2).
D: Qual è il normale punto di ebollizione del disolfuro di carbonio?
R: Il normale punto di ebollizione del disolfuro di carbonio è di circa 46,3°C (115,3°F).
D: Il disolfuro di carbonio è polare o non polare?
R: Il disolfuro di carbonio (CS2) è una molecola non polare a causa della sua forma lineare e dell’equa condivisione degli elettroni.
D: Qual è la formula del disolfuro di carbonio?
R: La formula del disolfuro di carbonio è CS2.
D: Cos’è il disolfuro di carbonio?
R: Il disolfuro di carbonio (CS2) è un composto chimico volatile composto da un atomo di carbonio e due atomi di zolfo, utilizzato in varie applicazioni industriali.
D: Quanto è importante il fatto che il disolfuro di carbonio sia più denso dell’acqua?
R: La maggiore densità del disolfuro di carbonio rispetto all’acqua significa che non si mescolerà facilmente e formerà strati distinti quando combinato.
D: In che modo gli esseri umani possono incontrare il disolfuro di carbonio?
R: Gli esseri umani possono entrare in contatto con il disolfuro di carbonio attraverso processi industriali, applicazioni chimiche o manipolando determinati prodotti.
D: Cosa succede se ingerisci disolfuro di carbonio?
R: L’ingestione di solfuro di carbonio può causare problemi di salute tra cui nausea, mal di testa ed effetti sul sistema nervoso, rendendolo pericoloso per la salute umana.
D: Il disolfuro di carbonio è più denso dell’acqua?
R: Sì, il disolfuro di carbonio è più denso dell’acqua, con una densità di circa 1,26 g/ml rispetto alla densità dell’acqua di 1 g/ml.
