Il solfato di ferro (ii) è un composto chimico contenente ioni ferro e solfato. È comunemente usato nel trattamento delle acque e come integratore nutritivo per le piante.
| Nome IUPAC | Solfato di ferro (II). |
| Formula molecolare | FeSO4 |
| numero CAS | 7720-78-7 |
| Sinonimi | Solfato ferroso, solfato di ferro, vetriolo verde, melanterite, szomolnokite |
| InChI | InChI=1S/Fe.H2O4S/c;1-5(2,3)4/h;(H2,1,2,3,4)/q+2;/p-2 |
Proprietà del solfato di ferro (ii).
Formula del solfato di ferro (II).
La formula chimica del solfato di ferro (II) è FeSO4. Questa formula indica che il solfato ferroso è costituito da un atomo di ferro, un atomo di zolfo e quattro atomi di ossigeno. La formula del solfato ferroso è un parametro importante per il calcolo di varie proprietà fisiche e chimiche del composto, come la massa molare e il peso molecolare.
Massa molare del solfato di ferro (II).
La massa molare del solfato ferroso è 151,91 g/mol. Questo valore rappresenta la massa di una mole di solfato ferroso, che contiene 1 atomo di ferro, 1 molecola di zolfo e 4 molecole di ossigeno. La massa molare è un parametro importante per il calcolo di varie proprietà fisiche e chimiche del solfato ferroso, come densità e concentrazione.
Punto di ebollizione del solfato di ferro(II).
Il solfato ferroso non ha un punto di ebollizione specifico perché subisce una decomposizione prima di raggiungere il punto di ebollizione. A pressione atmosferica inizia a decomporsi intorno ai 300°C. Questa decomposizione comporta la perdita di acqua e triossido di zolfo, lasciando dietro di sé ossido di ferro (III). Questo comportamento di decomposizione limita l’uso del solfato ferroso nelle applicazioni ad alta temperatura.
Solfato di ferro(II) Punto di fusione
Il punto di fusione del solfato ferroso dipende dal grado di idratazione. Il solfato ferroso anidro fonde a 695°C, mentre l’eptaidrato fonde a 64°C. Il solfato ferroso può esistere in diverse forme idratate, ciascuna con un diverso punto di fusione. Il punto di fusione del solfato ferroso è un parametro importante per determinare le migliori condizioni per la preparazione e la manipolazione del composto.
Densità del solfato di ferro (II) g/mL
La densità del solfato ferroso varia a seconda del grado di idratazione. Il solfato ferroso anidro ha una densità di 3,65 g/mL, mentre la forma eptaidrata ha una densità di 1,897 g/mL. La densità del solfato ferroso è un parametro importante per il calcolo del volume di una determinata massa del composto.
Peso molecolare del solfato di ferro (II).
Il peso molecolare del solfato ferroso è 151,91 g/mol. Questo valore rappresenta la somma dei pesi atomici degli atomi costituenti una molecola di solfato ferroso. Il peso molecolare è un parametro importante per calcolare varie proprietà fisiche e chimiche del solfato ferroso, come il punto di ebollizione e la solubilità.
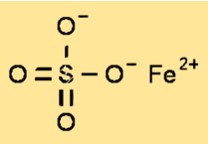
Struttura del solfato di ferro (II).
Il solfato ferroso ha una struttura cristallina che appartiene al sistema monoclino. La struttura cristallina del solfato ferroso è costituita da cationi ferro (II) circondati da sei molecole d’acqua e anioni solfato. La struttura cristallina del solfato ferroso è un parametro importante per comprendere le proprietà fisiche e chimiche del composto.
| Aspetto | Polvere cristallina bianca o verde chiaro |
| Peso specifico | 3,65 g/cm3 (anidro) |
| Colore | Verde pallido |
| Odore | Inodore |
| Massa molare | 151,91 g/mole |
| Densità | 3,65 g/cm3 (anidro), 1,89 g/cm3 (eptaidrato) |
| Punto di fusione | 695°C (anidro), 64°C (eptaidrato) |
| Punto di ebollizione | Si decompone prima di raggiungere il punto di ebollizione |
| Punto flash | Non applicabile |
| solubilità in acqua | Molto solubile |
| Solubilità | Solubile in acqua, insolubile in etanolo |
| Pressione del vapore | Non applicabile |
| Densità del vapore | Non applicabile |
| pKa | Non applicabile |
| pH | 4 (soluzione 0,1 M) |
Sicurezza e pericoli del solfato di ferro (ii)
Il solfato ferroso può comportare determinati rischi per la salute e la sicurezza umana. Può causare irritazione e arrossamento della pelle e degli occhi a contatto, e l’inalazione delle sue polveri può causare irritazione delle vie respiratorie. L’ingestione può causare dolore addominale, nausea, vomito e diarrea. Inoltre, l’esposizione al solfato ferroso può causare asma professionale e polmonite da ipersensibilità in soggetti predisposti. È importante seguire le corrette procedure di manipolazione e conservazione, indossare dispositivi di protezione individuale adeguati ed evitare di inalare o ingerire il composto. In caso di esposizione accidentale, consultare immediatamente un medico e consultare la scheda di sicurezza per consiglio.
| Simboli di pericolo | Xn,N |
| Descrizione della sicurezza | Tenere lontano da umidità, acidi e agenti ossidanti. Evitare il contatto con la pelle, gli occhi e gli indumenti. Non ingerire. Utilizzare con ventilazione adeguata. Lavarsi accuratamente le mani dopo la manipolazione. |
| Numeri di identificazione delle Nazioni Unite | UN3077, UN1376 |
| Codice SA | 2833.29.90 |
| Classe di pericolo | 9 (merci pericolose varie) |
| Gruppo di imballaggio | III |
| Tossicità | Nocivo se ingerito, provoca irritazione alla pelle e agli occhi, può causare irritazione alle vie respiratorie. Può provocare sensibilizzazione per inalazione o contatto con la pelle. |
Metodi per la sintesi del solfato di ferro(ii).
Esistono diversi metodi per sintetizzare il solfato ferroso.
Un metodo comune prevede la reazione dei depositi di ferro con acido solforico in presenza di acqua e ossigeno. Questo produce una soluzione di solfato ferroso eptaidrato, che può essere ulteriormente purificata mediante cristallizzazione.
Un altro metodo prevede la reazione dell’ossido di ferro con acido solforico ad alta temperatura, seguita dal raffreddamento e dalla filtrazione della soluzione risultante.
Un agente riducente, come polvere di ferro o anidride solforosa, può ridurre il solfato di ferro (III) a solfato ferroso. Questo produce solfato ferroso e acido solforico . Per preparare il solfato ferroso, il ferro può essere fatto reagire con anidride solforosa e ossigeno in presenza di acqua.
Un altro metodo prevede la reazione del ferro con acido solforico diluito in presenza di perossido di idrogeno . Questo produce solfato ferroso e acqua.
Usi del solfato di ferro (ii).
Il solfato di ferro (II) ha un’ampia gamma di applicazioni in vari settori, tra cui:
- Trattamento dell’acqua: comunemente utilizzato nel trattamento dell’acqua per rimuovere le impurità, come l’idrogeno solforato, dall’acqua.
- Fertilizzanti: utilizzati nella produzione di fertilizzanti per fornire alle piante nutrienti essenziali di ferro.
- Produzione di pigmenti: utilizzato come precursore per produrre vari pigmenti di ossido di ferro, come i pigmenti gialli e marroni.
- Supplementi nutrizionali: utilizzati come integratore nutrizionale per trattare l’anemia da carenza di ferro negli esseri umani e negli animali.
- Trattamento delle acque reflue: utilizzato nel trattamento delle acque reflue per rimuovere fosfati e altri contaminanti.
- Produzione di inchiostro: utilizzato nella produzione di inchiostro come agente annerente.
- Conservanti del legno: utilizzati come preservanti del legno per proteggere il legno dagli attacchi di funghi e insetti.
- Reagente di laboratorio: utilizzato come reagente di laboratorio in varie reazioni chimiche e analisi.
Domande:
Il solfato di ferro è solubile in acqua?
R: Il solfato di ferro, noto anche come solfato ferroso, è moderatamente solubile in acqua.
D: Qual è la formula del composto solfato di ferro(ii)?
R: La formula per il solfato ferroso è FeSO4.
D: Qual è la formula chimica del solfato di ferro(ii)?
R: La formula chimica del solfato ferroso è FeSO4.
D: Qual è la percentuale di zolfo nel solfato di ferro(ii)?
R: La percentuale di zolfo nel solfato ferroso è del 18,5%.
D: Il solfato di ferro(ii) è solubile in acqua?
R: Sì, il solfato di ferro II, noto anche come solfato ferroso, è solubile in acqua.
D: Cos’è il solfato ferroso?
R: Solfato ferroso è un altro nome per solfato ferroso, un composto chimico comunemente utilizzato in vari settori.
D: A cosa serve il solfato ferroso?
R: Il solfato ferroso viene utilizzato per diversi scopi, tra cui il trattamento delle acque, la produzione di fertilizzanti, la produzione di pigmenti, gli integratori alimentari, la produzione di inchiostri, i conservanti del legno e i reagenti coloranti. laboratorio.
