La dietilammina (DEA) è un composto chimico che ha un forte odore simile all’ammoniaca. Viene utilizzato nella produzione di pesticidi, prodotti farmaceutici e acceleranti della gomma. Ciò potrebbe causare irritazione alla pelle, agli occhi e al sistema respiratorio.
| Nome IUPAC | N,N-dietilmetanamina |
| Formula molecolare | C4H11N |
| numero CAS | 109-89-7 |
| Sinonimi | N-etiletanamina, DEA, dietilammino, N,N-dietilammina, N-etiletanamina, dietilammina |
Proprietà della dietilammina
Formula di dietilammina
La formula della dietilammina è C4H11N. È un’ammina alifatica primaria con due gruppi etilici attaccati all’atomo di azoto. La struttura molecolare della dietilammina contiene un atomo di azoto centrale legato a due gruppi etilici e un atomo di idrogeno.
Massa molare della dietilammina
La massa molare della DEA è 73,14 g/mol. Questo viene calcolato sommando le masse atomiche di tutti gli atomi presenti in una molecola DEA. La massa molare è un parametro importante utilizzato per calcolare la quantità di DEA necessaria per una determinata reazione chimica.
Punto di ebollizione della dietilammina
Il punto di ebollizione della DEA è 55,8°C. Ciò significa che a questa temperatura la forma liquida della DEA inizierà a vaporizzare e a trasformarsi in un gas. Il punto di ebollizione è un parametro importante che determina le condizioni necessarie affinché avvenga una reazione chimica.
Punto di fusione della dietilammina
Il punto di fusione della DEA è -49,8°C. Ciò significa che a questa temperatura la forma solida della DEA inizierà a sciogliersi e a trasformarsi in un liquido. Il punto di fusione è un parametro importante utilizzato per determinare la purezza della DEA.
Densità della dietilammina g/mL
La densità della DEA è 0,707 g/mL. Ciò significa che un millilitro di DEA pesa 0,707 grammi. La densità è un parametro importante utilizzato per calcolare la quantità di DEA necessaria per una determinata reazione chimica.
Peso molecolare della dietilammina
Il peso molecolare della DEA è 73,14 g/mol. È la somma dei pesi atomici di tutti gli atomi in una molecola DEA. Il peso molecolare è un parametro importante utilizzato per calcolare la quantità di DEA richiesta per una determinata reazione chimica.
Struttura della dietilammina
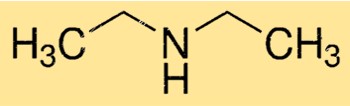
La DEA ha una struttura molecolare lineare, con l’atomo di azoto centrale legato a due gruppi etilici e un atomo di idrogeno. La molecola ha una forma piramidale trigonale a causa della coppia di elettroni solitari sull’atomo di azoto. Questa struttura è importante nel determinare la reattività e le proprietà della DEA.
Solubilità della dietilammina
La DEA è solubile in acqua e in molti solventi organici. Il suo pKa è 10,75, il che significa che è una base debole. La solubilità della DEA dipende da fattori quali temperatura, pH e polarità del solvente. La sua solubilità in acqua è di 100 g/L a 25°C.
| Aspetto | Liquido incolore |
| Peso specifico | 0,707 g/ml |
| Colore | Incolore |
| Odore | Simile all’ammoniaca |
| Massa molare | 73,14 g/mole |
| Densità | 0,707 g/ml |
| Punto di fusione | -49,8°C |
| Punto di ebollizione | 55,8°C |
| Punto flash | -15°C |
| solubilità in acqua | Solubile |
| Solubilità | Solubile in molti solventi organici |
| Pressione del vapore | 94,7 mmHg a 25°C |
| Densità del vapore | 2.5 |
| pKa | 10:75 |
| pH | Di base |
Sicurezza e pericoli della dietilammina
La DEA può essere pericolosa per la salute umana se non gestita correttamente. È corrosivo e può causare irritazione alla pelle, agli occhi e alle vie respiratorie a contatto. L’esposizione prolungata alla DEA può causare danni al fegato e ai reni. È infiammabile e può formare miscele esplosive con l’aria. Quando si maneggia il DAE è necessario adottare precauzioni speciali quali un’adeguata ventilazione, dispositivi di protezione individuale e contenitori di stoccaggio resistenti al fuoco. In caso di esposizione accidentale, è necessario consultare immediatamente un medico. È importante seguire tutte le linee guida e i protocolli di sicurezza quando si lavora con la DEA per proteggere te stesso e gli altri.
| Simboli di pericolo | Corrosivo, Infiammabile |
| Descrizione della sicurezza | Tenere lontano da fonti di calore, scintille, fiamme libere e superfici calde. Evitare di respirare vapori, nebbie o gas. Indossare guanti protettivi, protezione per gli occhi e protezione per il viso. Utilizzare in un’area ben ventilata. |
| Numeri di identificazione delle Nazioni Unite | ONU 1154 |
| Codice SA | 29211990 |
| Classe di pericolo | 3 |
| Gruppo di imballaggio | II |
| Tossicità | Può causare irritazione alla pelle, agli occhi e alle vie respiratorie. L’esposizione prolungata può causare danni al fegato e ai reni. |
Metodi per la sintesi della dietilammina
Esistono diversi metodi per sintetizzare la DEA, inclusa la reazione di etanolo e ammoniaca o la reazione di dietilsolfato e ammoniaca.
Un metodo prevede il riscaldamento di una miscela di etanolo e ammoniaca in presenza di un catalizzatore, come allumina o gel di silice. La reazione produce DEA e acqua, che possono essere separati mediante distillazione.
Un altro metodo prevede la reazione del dietil solfato con l’ammoniaca . La reazione avviene in un solvente, come metanolo o etanolo, e produce solfato DEA. Per produrre DEA e solfato di sodio, il solfato DEA può essere trattato con una base forte, come l’idrossido di sodio.
Per sintetizzare la DEA, l’etilene può essere fatto reagire con l’ammoniaca in presenza di un catalizzatore, come l’ossido di ferro. La reazione produce una miscela di DEA e trietilammina, che può essere separata mediante distillazione.
Quando si sintetizza la DEA, è necessario prestare attenzione poiché i reagenti e i prodotti possono comportare rischi per la salute umana e l’ambiente. Pertanto, è necessario utilizzare misure e attrezzature di sicurezza adeguate durante il processo di sintesi.
Usi della dietilammina
La DEA ha diversi usi in diversi settori grazie alle sue proprietà uniche. Ecco alcuni dei suoi usi comuni:
- Prodotti farmaceutici: utilizzati come elemento costitutivo nella sintesi di prodotti farmaceutici, come anestetici locali e antistaminici.
- Prodotti chimici agricoli: utilizzati come materia prima nella produzione di erbicidi, come il glifosato.
- Industria della gomma: Utilizzato nella produzione di acceleranti per la vulcanizzazione della gomma.
- Industria dei coloranti: utilizzata nella produzione di coloranti e pigmenti, come coloranti acidi e coloranti reattivi.
- Inibitori della corrosione: utilizzati come inibitori della corrosione nell’industria petrolifera per proteggere tubazioni e serbatoi di stoccaggio dalla corrosione.
- Solventi: Utilizzato come solvente nella produzione di resine sintetiche e polimeri.
- Sintesi chimica: utilizzato anche come reagente in un’ampia gamma di reazioni di sintesi chimica.
Domande:
D: Cos’è più basico, trietilammina o dietilammina?
R: La trietilammina è più basica della DEA a causa delle sue dimensioni maggiori e della presenza di tre gruppi etilici che aiutano ad aumentare la densità elettronica.
D: Qual è il pH della dietilammina 0,10 M, (CH3CH2)2NH, (Kb = 8,6 × 10−4)?
R: Il pH di una soluzione DEA 0,10 M può essere calcolato utilizzando il valore Kb e l’equazione della costante di dissociazione della base. Il pH della soluzione è circa 10,49.
D: Qual è il pH della dietilammina 0,11 M, (CH3CH2)2NH, (Kb = 8,6 × 10−4)?
R: Il pH di una soluzione DEA 0,11 M può essere calcolato utilizzando il valore Kb e l’equazione della costante di dissociazione della base. Il pH della soluzione è circa 10,50.
D: Qual è l’entalpia standard di formazione della dietilammina liquida, (CH3CH2)2NH?
R: L’entalpia standard di formazione del DEA liquido è -42,52 kJ/mol.
D: La dietilammina è polare?
R: Sì, la DEA è polare a causa della presenza di un atomo di azoto con una coppia di elettroni solitari e della differenza di elettronegatività tra azoto e carbonio.
D: Cos’è più basico, dietilammina o trietilammina?
R: La trietilammina è più basica della DEA a causa della presenza di tre gruppi etilici che aiutano ad aumentare la densità elettronica.
D: Qual è il pH di una soluzione di dietilammina 0,10 M?
R: Il pH di una soluzione DEA 0,10 M può essere calcolato utilizzando il valore Kb e l’equazione della costante di dissociazione della base. Il pH della soluzione è circa 10,49.
D: La dietilammina è un acido forte o debole?
R: La DEA è una base debole, non un acido forte. Reagisce con l’acqua per produrre ioni idrossido e ioni dietilammonio.
