L’etere etilico o etossietano è un liquido incolore, altamente infiammabile e volatile comunemente utilizzato come solvente e come materiale di partenza per la sintesi di altri composti organici.
| Nome IUPAC | Etossietano |
| Formula molecolare | C4H10O |
| numero CAS | 60-29-7 |
| Sinonimi | Etere, etere etilico, ossido di etile, ossido di dietile, 1,1′-ossibisetano, etere, etere anestetico, etere solforico, etere etilico |
| InChI | InChI=1S/C4H10O/c1-3-5-4-2/h3-4H2.1-2H3 |
Proprietà dell’etere etilico
Densità dell’etere etilico g/ml
La densità dell’etere etilico è 0,713 g/mL. La densità è definita come la massa di una sostanza per unità di volume. Nel caso dell’etere etilico, la sua densità è inferiore a quella dell’acqua, che ha una densità di 1 g/mL. Ciò significa che l’etere etilico galleggia sulla superficie dell’acqua.
Massa molare dell’etere etilico
L’etere etilico ha una massa molare di 74,12 g/mol. La massa molare è la massa di una mole di una sostanza, espressa in grammi. Nel caso dell’etossietano, una mole del composto contiene 74,12 grammi. Questo valore deriva dalle masse atomiche di carbonio, idrogeno e ossigeno che compongono la molecola. La massa molare di una sostanza è un parametro importante nei calcoli chimici perché viene utilizzata per determinare la quantità di sostanza presente in un dato campione.
Struttura dell’etere etilico
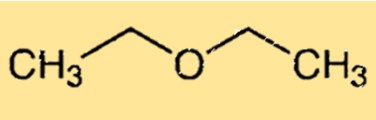
L’etere etilico ha una struttura chimica semplice costituita da due gruppi etilici attaccati a un atomo di ossigeno. La molecola ha una forma piegata a causa della coppia solitaria di elettroni sull’atomo di ossigeno che fa sì che la molecola si distorca dalla geometria tetraedrica ideale. La struttura curva dell’etossietano è responsabile della sua capacità di formare legami idrogeno con altre molecole, rendendolo un utile solvente.
Punto di ebollizione dell’etere etilico
Il punto di ebollizione dell’etere etilico è 34,6°C (94,3°F). Il punto di ebollizione è la temperatura alla quale una sostanza passa dallo stato liquido allo stato gassoso a pressione atmosferica. L’etere etilico ha un punto di ebollizione relativamente basso, che lo rende un liquido volatile che evapora facilmente a temperatura ambiente. Questa proprietà lo rende utile come solvente e come anestetico in medicina.
Punto di fusione dell’etere etilico
Il punto di fusione dell’etossietano è -116,3°C (-177,3°F). Il punto di fusione è la temperatura alla quale una sostanza solida passa allo stato liquido a pressione atmosferica. L’etossietano è un liquido incolore a temperatura ambiente ed è raro vederlo allo stato solido a causa del suo basso punto di fusione.
Peso molecolare dell’etere etilico
L’etossietano ha un peso molecolare di 74,12 g/mol. Il peso molecolare è la somma dei pesi atomici di tutti gli atomi presenti in una molecola. È un parametro importante nelle reazioni chimiche e nella stechiometria perché determina la quantità di reagente necessaria per formare una quantità specifica di prodotto.
Formula dell’etere etilico
La formula chimica dell’etossietano è C4H10O. È composto da quattro atomi di carbonio, dieci atomi di idrogeno e un atomo di ossigeno. La formula rappresenta il numero esatto di ciascun tipo di atomo in una molecola e viene utilizzata per determinare il peso molecolare della sostanza. La formula chimica di una sostanza è essenziale nelle equazioni chimiche, dove viene utilizzata per bilanciare le reazioni e determinare la quantità di reagenti e prodotti.
| Aspetto | Liquido incolore |
| Peso specifico | 0,713 |
| Colore | Incolore |
| Odore | Morbido, come l’etere |
| Massa molare | 74,12 g/mole |
| Densità | 0,713 g/ml |
| Punto di fusione | -116,3°C (-177,3°F) |
| Punto di ebollizione | 34,6°C (94,3°F) |
| Punto flash | -45°C (-49°F) |
| solubilità in acqua | 6,9 g/l a 25°C |
| Solubilità | Miscibile nella maggior parte dei solventi organici |
| Pressione del vapore | 440 mmHg a 25°C |
| Densità del vapore | 2.5 |
| pKa | 15.9 |
| pH | 7 (neutro) |
Dietiletere Sicurezza e pericoli
L’etossietano presenta diverse considerazioni sulla sicurezza e sui rischi che devono essere prese in considerazione durante la manipolazione. È altamente infiammabile e può formare miscele vapore-aria esplosive. Deve quindi essere tenuto lontano da fonti di ignizione e scintille. Può anche causare irritazione alla pelle, agli occhi e al sistema respiratorio e un’esposizione prolungata può causare vertigini e mal di testa. Quando si utilizza l’etossietano è necessaria una ventilazione adeguata e devono essere indossati dispositivi di protezione come guanti e occhiali protettivi. Inoltre deve essere conservato in un luogo fresco e asciutto, lontano da agenti ossidanti e materiali incompatibili.
| Simboli di pericolo | F, Xi |
| Descrizione della sicurezza | S9, S16, S29, S33, S60, S61 |
| Numeri di identificazione delle Nazioni Unite | ONU 1155 |
| Codice SA | 2909.19.00 |
| Classe di pericolo | 3 |
| Gruppo di imballaggio | II |
| Tossicità | LD50 (orale, ratto): 3.500 mg/kg |
Metodi per la sintesi dell’etere etilico
Esistono vari metodi per sintetizzare l’etere etilico, inclusa la reazione dell’etanolo con acido solforico e la disidratazione dell’etanolo utilizzando un agente disidratante come acido solforico o allumina.
Per sintetizzare l’etossietano tramite il metodo di disidratazione, riscaldare l’etanolo con un agente disidratante come acido solforico o allumina per rimuovere una molecola d’acqua, formando etossietano. Per migliorare la resa della reazione si può utilizzare un catalizzatore come idrossido di potassio o idrossido di sodio.
Un altro metodo per sintetizzare l’etossietano è sintetizzare l’etere Williamson, dove l’etanolo reagisce con uno ione alcossido come l’etossido di sodio per formare etossietano. Questa reazione richiede l’uso di una base forte e di un solvente adatto, come l’etanolo anidro.
Un altro metodo per produrre etossietano è utilizzare la reazione Tishchenko. In questo processo, l’acido acetico e l’etanolo reagiscono in presenza di un catalizzatore come l’acido solforico o l’ossido di alluminio, ottenendo un’elevata resa di etossietano.
Per produrre etossietano come prodotto finale, è possibile utilizzare boroidruro di sodio o amalgama di sodio per ridurre l’acetaldeide. Questo è un altro metodo per sintetizzare l’etossietano. Questa reazione porta alla formazione di etanolo , che può poi subire il metodo di disidratazione sopra descritto per formare etossietano.
Usi dell’etere etilico
Alcuni usi dell’etere etilico includono:
- Solvente: un solvente molto efficace per una gamma di composti organici tra cui oli, grassi, resine e cere. Utilizzato nella produzione di lacche, vernici e altri rivestimenti.
- Anestetico: utilizzato come anestetico per le procedure chirurgiche, sebbene sia stato in gran parte sostituito da alternative più sicure nella medicina moderna.
- Estrazione: utilizzato come solvente di estrazione nella produzione di prodotti farmaceutici, prodotti naturali e oli essenziali.
- Additivo per carburante: utilizzato come additivo per carburante per migliorare le prestazioni dei motori diesel, poiché può aumentare il numero di cetano del carburante.
- Intermedio chimico: un intermedio chiave nella produzione di una gamma di composti organici, tra cui etanolo, acetaldeide e acido acetico.
- Agente aromatizzante: utilizzato come agente aromatizzante nella produzione di alcuni alimenti e bevande, come caramelle e liquori.
- Reagente di laboratorio: utilizzato come reagente negli esperimenti di laboratorio, in particolare nella chimica organica.
- Propellente aerosol: utilizzato come propellente nei prodotti aerosol. Le preoccupazioni per la sicurezza portarono al graduale abbandono di questo uso.
Domande:
D: L’etere etilico è polare?
R: Sì, l’etossietano è una molecola polare a causa della presenza dell’atomo di ossigeno, che crea una carica parziale negativa su un’estremità della molecola e una carica parziale positiva sull’altra estremità.
D: L’etere etilico è miscibile con l’acqua?
R: L’etossietano non è molto solubile in acqua. Tuttavia, è considerato parzialmente miscibile con l’acqua, il che significa che può mescolarsi con l’acqua in una certa misura ma non completamente.
D: L’etere etilico è infiammabile?
R: Sì, l’etossietano è altamente infiammabile e può formare miscele esplosive con l’aria.
D: L’etere etilico è polare o non polare?
R: L’etossietano è una molecola polare a causa della presenza dell’atomo di ossigeno.
D: L’etere etilico è aprotico polare?
R: Sì, l’etossietano è considerato un solvente aprotico polare, il che significa che può dissolvere molecole polari ma non ha un atomo di idrogeno che possa agire come donatore di legami idrogeno.
