Il cloruro di zinco (ZnCl2) è un composto cristallino bianco. Viene utilizzato in varie applicazioni industriali come flussi di saldatura, sintesi chimica e zincatura. È molto solubile in acqua.
| Nome IUPAC | Cloruro di zinco |
| Formula molecolare | ZnCl2 |
| numero CAS | 7646-85-7 |
| Sinonimi | Burro di zinco; Cloruro di zinco; Cloruro di zinco(II); Burro di zinco; CI77043 |
| InChI | InChI=1S/2ClH.Zn/h2*1H;/q;;+2/p-2 |
Proprietà del cloruro di zinco
Formula di cloruro di zinco
La formula chimica del dicloruro di zinco è ZnCl2. È composto da un atomo di zinco (Zn) e due atomi di cloro (Cl). Questo composto ionico forma un solido cristallino bianco con una struttura distinta.
Massa molare del cloruro di zinco
La massa molare del dicloruro di zinco è di circa 136,29 grammi per mole (g/mol). Deriva dalla somma delle masse atomiche di un atomo di zinco e due atomi di cloro.
Punto di ebollizione del cloruro di zinco
Il dicloruro di zinco ha un punto di ebollizione relativamente alto di circa 732 gradi Celsius (C) o 1.350 gradi Fahrenheit (F). A questa temperatura passa dallo stato liquido a quello gassoso.
Punto di fusione del cloruro di zinco
Il punto di fusione del dicloruro di zinco è di circa 290 gradi Celsius (C) o 554 gradi Fahrenheit (F). A questa temperatura il dicloruro di zinco solido passa allo stato liquido.
Densità del cloruro di zinco g/mL
La densità del dicloruro di zinco è di circa 2,91 grammi per millilitro (g/mL) a temperatura ambiente. Questa proprietà descrive la sua massa per unità di volume.
Peso molecolare del cloruro di zinco
Il peso molecolare del dicloruro di zinco, calcolato dalla sua formula chimica, è di circa 136,29 g/mol. Questo valore rappresenta la somma dei pesi atomici dei suoi atomi costituenti.
Struttura del cloruro di zinco
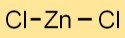
Il dicloruro di zinco ha una struttura reticolare cristallina con cationi Zn2+ e Clanioni tenuti insieme da legami ionici. La disposizione forma una rete tridimensionale stabile e ordinata.
Solubilità del cloruro di zinco
Il dicloruro di zinco è molto solubile in acqua, il che significa che si dissolve facilmente in presenza di molecole d’acqua. Questa proprietà contribuisce al suo utilizzo diffuso in varie applicazioni industriali e processi chimici.
| Aspetto | Solido cristallino bianco |
| Peso specifico | 2,91 g/ml |
| Colore | Incolore |
| Odore | Inodore |
| Massa molare | 136,29 g/mole |
| Densità | 2,91 g/cm³ |
| Punto di fusione | 290°C (554°F) |
| Punto di ebollizione | 732°C (1350°F) |
| Punto flash | Non applicabile |
| solubilità in acqua | Molto solubile in acqua |
| Solubilità | Solubile in solventi organici come alcool e acetone |
| Pressione del vapore | 1 mmHg a 359°C |
| Densità del vapore | 5.4 (aria = 1) |
| pKa | -1.9 |
| pH | ~5 (soluzione 0,1 M in acqua) |
Sicurezza e pericoli del cloruro di zinco
Il dicloruro di zinco presenta alcuni rischi per la sicurezza che richiedono un’attenta manipolazione. Il contatto diretto con la pelle o gli occhi può causare irritazioni e ustioni. L’inalazione dei suoi vapori può irritare le vie respiratorie. È essenziale indossare dispositivi di protezione come guanti e occhiali durante la manipolazione del composto. Inoltre, deve essere conservato in un’area ben ventilata, lontano da sostanze incompatibili. In caso di ingestione o esposizione accidentale consultare immediatamente un medico. Evitare di disperderlo nell’ambiente poiché potrebbe essere dannoso per la vita acquatica. Seguendo le misure di sicurezza e le linee guida adeguate, i rischi associati al dicloruro di zinco possono essere ridotti al minimo in modo efficace.
| Simboli di pericolo | Corrosivo (C); Nocivo (Xn) |
| Descrizione della sicurezza | Evitare il contatto con la pelle e gli occhi. Utilizzare in un’area ben ventilata. Indossare guanti e occhiali protettivi. In caso di contatto o ingestione consultare un medico. Non disperdere nell’ambiente. Tenere lontano da sostanze incompatibili. |
| Numeri di identificazione delle Nazioni Unite | N° ONU 2331 (Dicloruro di zinco anidro); N. ONU 2332 (Dicloruro di zinco, soluzione) |
| Codice SA | 28273990 |
| Classe di pericolo | 8 (Sostanze corrosive) |
| Gruppo di imballaggio | II (Pericolo medio) |
| Tossicità | Nocivo se ingerito o inalato. |
Metodi per la sintesi del cloruro di zinco
Vari metodi consentono la sintesi del dicloruro di zinco.
Un approccio comune prevede la reazione dell’ossido di zinco (ZnO) con acido cloridrico (HCl) . In questo metodo, un chimico aggiunge lentamente ZnO a una soluzione di HCl mescolando continuamente. La reazione produce dicloruro di zinco e acqua come sottoprodotti. Un altro metodo consiste nel combinare direttamente lo zinco metallico con il cloro gassoso (Cl2). Questa reazione richiede un attento controllo della temperatura e della pressione per garantire un risultato positivo.
Un processo alternativo prevede la dissoluzione dello zinco metallico in una soluzione di HCl, con conseguente formazione di dicloruro di zinco e idrogeno gassoso (H2). Il trattamento dell’HCl con carbonato di zinco (ZnCO3) o idrossido di zinco (Zn(OH)2) produce dicloruro di zinco, acqua e anidride carbonica (CO2) come sottoprodotti.
Il solfato di zinco (ZnSO4) e il cloruro di bario (BaCl2) subiscono una doppia reazione di decomposizione per produrre dicloruro di zinco e la formazione di solfato di bario (BaSO4). Miscelando questi due composti, il dicloruro di zinco precipita, mentre il solfato di bario (BaSO4) rimane nella soluzione.
Ciascuno di questi metodi fornisce un percorso per la sintesi del dicloruro di zinco e la scelta del metodo dipende da fattori quali la disponibilità di reagenti, le condizioni di reazione e la purezza desiderata del prodotto finale.
Usi del cloruro di zinco
Il dicloruro di zinco trova un’ampia gamma di applicazioni in vari settori grazie alle sue proprietà versatili. Ecco alcuni usi importanti del dicloruro di zinco:
- Galvanizzazione: il dicloruro di zinco svolge un ruolo essenziale nel processo di zincatura per prevenire la corrosione di metalli come acciaio e ferro. Forma un rivestimento protettivo di zinco, migliorandone la longevità e la durata.
- Flusso di saldatura: nelle operazioni di brasatura, il dicloruro di zinco agisce come un flusso per rimuovere gli ossidi metallici dalla superficie dei metalli, fornendo una migliore adesione e un forte legame tra la saldatura e il metallo.
- Sintesi chimica: funge da catalizzatore o reagente in molte reazioni chimiche, come l’acilazione e la disidratazione di Friedel-Crafts.
- Conservazione del legno: le applicazioni per la preservazione del legno utilizzano il dicloruro di zinco per proteggere il legno dalla putrefazione fungina e dagli insetti, prolungandone la vita.
- Lavorazione tessile: nell’industria tessile, facilita la produzione di tessuti di cotone mercerizzato, conferendo proprietà desiderabili come maggiore lucentezza e maggiore resistenza.
- Elettrolita della batteria: il dicloruro di zinco agisce come un elettrolita in alcune batterie, come la batteria zinco-carbone, contribuendo a facilitare il flusso di ioni tra gli elettrodi.
- Deodorante e antitraspirante: è un ingrediente comune negli antitraspiranti grazie alle sue proprietà astringenti che aiutano a ridurre la produzione di sudore e a controllare l’odore corporeo.
- Prodotti farmaceutici: il dicloruro di zinco trova applicazione in varie formulazioni farmaceutiche, in particolare in collutori, pastiglie per la gola e soluzioni antisettiche topiche.
- Industria della tintura: l’industria della tintura utilizza il dicloruro di zinco come mordente nel processo di tintura per migliorare la solidità del colore dei tessuti con coloranti.
- Formulazioni adesive: i produttori incorporano il dicloruro di zinco nelle formulazioni adesive per migliorare le proprietà di adesione di colle e cementi.
La versatilità del dicloruro di zinco lo rende un composto essenziale in molti processi industriali e prodotti di uso quotidiano, contribuendo al progresso di diversi settori chiave.
Domande:
D: ZnCl2 è solubile in acqua?
R: Sì, ZnCl2 è altamente solubile in acqua.
D: Qual è l’equazione ionica netta per la reazione di ZnCl2 con NaOH?
R: L’equazione ionica netta è Zn²⁺(aq) + 2OH⁻(aq) → Zn(OH)₂(s).
D: ZnCl2 è solubile?
R: Sì, ZnCl2 è solubile in acqua.
D: ZnCl2 è ionico o molecolare?
R: ZnCl2 è un composto ionico.
D: Che tipo di legame si verifica nel cloruro di zinco(II), ZnCl2?
R: Il legame ionico avviene in ZnCl2.
D: Quale cambiamento potrebbe diminuire il tasso di produzione di ZnCl2?
R: L’abbassamento della temperatura di reazione potrebbe ridurre la velocità di produzione di ZnCl2.
D: ZnCl2 è solido?
R: Sì, ZnCl2 è un solido a temperatura ambiente.
D: ZnCl2 è un sale?
R: Sì, ZnCl2 è considerato un sale.
D: Come si ottiene il cloruro di zinco dallo zinco?
R: La reazione dello zinco con l’acido cloridrico produrrà cloruro di zinco.
D: Qual è la formula del cloruro di zinco?
R: La formula del cloruro di zinco è ZnCl2.
D: Le batterie al cloruro di zinco sono dannose per la terra?
R: Sì, le batterie al cloruro di zinco possono essere dannose per l’ambiente se non smaltite correttamente.
D: Qual è la massa molare del cloruro di zinco?
R: La massa molare del cloruro di zinco è circa 136,29 g/mol.
