Il cloruro di tionile è un composto chimico utilizzato in varie applicazioni industriali. Reagisce con gli alcoli e gli acidi carbossilici, producendo rispettivamente i corrispondenti cloruri e cloruro di solforile.
| Nome dell’IUPAC | Cloruro di tionile |
| Formula molecolare | SOCl₂ |
| numero CAS | 7719-09-7 |
| Sinonimi | Cloruro di zolfo, Ossicloruro di zolfo, Dicloruro di tionile |
| InChI | InChI=1S/Cl2OS/c1-4(2)3 |
Proprietà del cloruro di tionile
Formula del cloruro di tionile
La formula del dicloruro di tionile è SOCl₂, che rappresenta un atomo di zolfo legato a due atomi di cloro. È un composto chimico ampiamente utilizzato in vari settori.
Massa molare del cloruro di tionile
Il dicloruro di tionile ha una massa molare di circa 118,97 grammi per mole. La massa molare si determina sommando le masse atomiche dei suoi elementi costitutivi.
Punto di ebollizione del cloruro di tionile
Il dicloruro di tionile ha un punto di ebollizione di circa 79,6 gradi Celsius. Questa è la temperatura alla quale la forma liquida del dicloruro di tionile passa allo stato gassoso.
Punto di fusione del cloruro di tionile
Il punto di fusione del dicloruro di tionile è di circa -104,5 gradi Celsius. Questa è la temperatura alla quale la forma solida del dicloruro di tionile passa allo stato liquido.
Densità del cloruro di tionile g/mL
Il dicloruro di tionile ha una densità di circa 1,64 grammi per millilitro. La densità è la misura della massa per unità di volume ed è una caratteristica importante di una sostanza.
Peso molecolare del cloruro di tionile
Il peso molecolare del dicloruro di tionile è di circa 118,97 grammi per mole. Si calcola sommando i pesi atomici di zolfo, cloro e ossigeno.
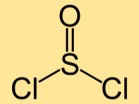
Struttura del cloruro di tionile
La struttura del dicloruro di tionile è costituita da un atomo di zolfo legato a due atomi di cloro. Gli atomi di zolfo e cloro sono disposti linearmente, formando una molecola a forma curva.
Solubilità del cloruro di tionile
Il dicloruro di tionile è scarsamente solubile in acqua ma si dissolve facilmente in solventi organici come benzene, toluene e tetracloruro di carbonio. La sua solubilità è un fattore importante nelle sue applicazioni.
| Aspetto | Liquido da incolore a giallo pallido |
| Peso specifico | 1.638 g/ml |
| Colore | Incolore |
| Odore | Pungente, soffocante |
| Massa molare | 118,97 g/mole |
| Densità | 1.638 g/ml |
| Punto di fusione | -104,5°C |
| Punto di ebollizione | 79,6°C |
| Punto flash | Non applicabile |
| solubilità in acqua | Reagisce violentemente |
| Solubilità | Solubile in solventi organici come benzene, toluene e tetracloruro di carbonio |
| Pressione del vapore | 4,33 kPa a 20°C |
| Densità del vapore | 3,9 (aria = 1) |
| pKa | -6.3 |
| pH | Non applicabile |
Sicurezza e pericoli del cloruro di tionile
Il dicloruro di tionile presenta diversi rischi per la sicurezza e deve essere maneggiato con cura. È molto corrosivo e può provocare gravi ustioni a contatto con la pelle, gli occhi o le mucose. L’inalazione dei suoi vapori può causare irritazioni e danni respiratori. Il composto reagisce violentemente con l’acqua, liberando gas tossici, come l’acido cloridrico. Deve quindi essere immagazzinato e maneggiato lontano da fonti di umidità. Il dicloruro di tionile reagisce vigorosamente anche con gli alcoli e i composti contenenti acqua, il che può provocare rischi di incendio o esplosione. Una ventilazione adeguata, dispositivi di protezione individuale e pratiche di conservazione adeguate sono essenziali per garantire una manipolazione sicura del dicloruro di tionile.
| Simboli di pericolo | Corrosivo (C), Tossico (T), Pericoloso per l’ambiente (N) |
| Descrizione della sicurezza | – Tenere lontano da fonti di umidità e sostanze incompatibili.<br>- Utilizzare in un’area ben ventilata e indossare dispositivi di protezione individuale adeguati.<br>- Maneggiare con cura per evitare il contatto con la pelle, gli occhi e le mucose.<br> – Conservare in un contenitore ermeticamente chiuso in un luogo fresco e asciutto. |
| Numeri di identificazione delle Nazioni Unite | N. ONU 1836 (Dicloruro di tionile) |
| Codice SA | 2812.10.00 |
| Classe di pericolo | 8 (Sostanze corrosive) |
| Gruppo di imballaggio | II (moderatamente pericoloso) |
| Tossicità | Molto tossico per inalazione, ingestione e assorbimento cutaneo.<br>- Può provocare gravi ustioni e irritazioni respiratorie.<br>- Può provocare effetti nocivi a lungo termine sugli organismi acquatici. |
Metodi per la sintesi del cloruro di tionile
Diversi metodi consentono la sintesi del dicloruro di tionile.
Un approccio comune prevede la reazione tra triossido di zolfo (SO₃) e dicloruro di zolfo (SCl₂) in presenza di un catalizzatore come carbone attivo o cloruro di alluminio . La reazione avviene a temperature elevate, solitamente intorno ai 300-400 °C, e produce quindi dicloruro di tionile.
Un altro metodo prevede la reazione diretta dell’anidride solforosa (SO₂) con il pentacloruro di fosforo (PCl₅) o l’ossicloruro di fosforo (POCl₃). Questa reazione avviene a riflusso, con progressiva aggiunta dei reagenti, e porta al dicloruro di tionile.
La reazione dello zolfo con il tricloruro di fosforo (PCl3) dà il dicloruro di tionile. Questo processo prevede il riscaldamento dei reagenti e la formazione di dicloruro di tionile.
Un altro metodo prevede la reazione tra pentasolfuro di fosforo (P2S5) e pentacloruro di fosforo (PCl5) in presenza di un catalizzatore acido di Lewis come il cloruro di alluminio. La reazione avviene ad alte temperature e provoca la formazione di dicloruro di tionile.
È importante notare che questi metodi di sintesi richiedono una corretta manipolazione e precauzioni di sicurezza a causa della natura pericolosa dei reagenti coinvolti. La sintesi sicura ed efficiente del dicloruro di tionile richiede l’esperienza di chimici esperti e l’uso di adeguate attrezzature di laboratorio.
Usi del cloruro di tionile
Il dicloruro di tionile trova ampie applicazioni in vari settori grazie alle sue proprietà chimiche versatili. Ecco alcuni usi comuni del dicloruro di tionile:
- Conversione di acidi carbossilici: il dicloruro di tionile converte gli acidi carbossilici in cloruri acilici, utilizzando in gran parte la reazione Vilsmeier-Haack nella sintesi organica.
- Clorazione degli alcol: il dicloruro di tionile reagisce con gli alcoli, formando cloruri alchilici e trovando applicazione nella produzione di composti clorurati per prodotti farmaceutici e agrochimici, nota come reazione di Darzens.
- Agente disidratante: il dicloruro di tionile agisce come agente disidratante, facilitando la rimozione di vari composti dall’acqua. È comunemente usato nella sintesi di coloranti, profumi e intermedi farmaceutici.
- Produzione di batterie agli ioni di litio: i produttori utilizzano il dicloruro di tionile per produrre batterie al litio-dicloruro di tionile, che hanno un’elevata densità di energia e una lunga durata. Queste batterie hanno applicazioni in dispositivi medici, attrezzature militari e sensori remoti.
- Reazioni di polimerizzazione: il dicloruro di tionile partecipa alle reazioni di polimerizzazione, contribuendo alla sintesi di vari polimeri, inclusi policarbonati e polianidridi.
- Composti del fosforo: il dicloruro di tionile reagisce con i composti del fosforo, come il tricloruro di fosforo, producendo cloruri di fosforile. I chimici utilizzano questi intermedi per sintetizzare composti organofosfati e ritardanti di fiamma.
- Reagente chimico: il dicloruro di tionile funge da reagente versatile in molte trasformazioni chimiche, comprese le reazioni di esterificazione, alogenazione e sostituzione nucleofila.
Domande:
D: Con cosa puoi sciacquare il cloruro di tionile?
R: Il dicloruro di tionile può essere risciacquato con un grande eccesso di alcol o base compatibile, come una soluzione di metanolo o bicarbonato di sodio.
D: Qual è il prodotto dell’acido valerico con il cloruro di tionile?
R: La reazione dell’acido valerico con il dicloruro di tionile produce cloruro di valerile e anidride solforosa.
D: Puoi aggiungere cloruro di tionile con un acido carbossilico?
R: Sì, il dicloruro di tionile può essere aggiunto a un acido carbossilico per convertirlo in cloruro acilico mediante la reazione di Vilsmeier-Haack.
D: Quale delle seguenti è la formula di Lewis corretta per il cloruro di tionile (SOCl2)?
R: La formula di Lewis corretta per il dicloruro di tionile (SOCl2) è rappresentata da S=O | Cl – Cl.
D: Cosa guida la reazione del cloruro di tionile?
R: La reazione del dicloruro di tionile è guidata dall’elevata reattività del cloruro di tionile, che agisce come un elettrofilo in varie trasformazioni chimiche.
D: Come estinguere il cloruro di tionile?
R: Il dicloruro di tionile può essere spento aggiungendo un agente di spegnimento adatto come un alcol primario o secondario oppure idrolizzandolo attentamente con acqua.
D: Cosa otterresti se mescoli le ammine con il cloruro di tionile?
R: La miscelazione delle ammine con il dicloruro di tionile determina la formazione dei corrispondenti sali cloridrati di ammina.
D: Cos’è il cloruro di tionile?
R: Il dicloruro di tionile è un composto chimico con la formula SOCl2, comunemente usato come reagente nella sintesi organica e come agente disidratante.
D: Cosa farà l’eccesso di cloruro di tionile?
R: Una quantità eccessiva di dicloruro di tionile può causare reazioni vigorose, che potrebbero portare alla produzione di gas tossici o pericolo di esplosione e deve essere maneggiato con cautela.
D: Come neutralizzare il cloruro di tionile?
R: Il dicloruro di tionile può essere neutralizzato aggiungendolo con attenzione a un grande eccesso di una base adatta, come bicarbonato di sodio o idrossido di sodio, garantendo al tempo stesso le opportune precauzioni di sicurezza.
