Il cloruro di solforile (SO2Cl2) è un composto formato dalla combinazione di anidride solforosa e cloro. Viene utilizzato come reagente nelle reazioni chimiche e come fumigante per controllare i parassiti.
| Nome IUPAC | Cloruro di solforile |
| Formula molecolare | SO2Cl2 |
| numero CAS | 7791-25-5 |
| Sinonimi | Cloruro di zolfo, Ossicloruro di zolfo, Ossido di cloruro di zolfo |
| InChI | InChI=1S/Cl2O2S/c1-5(2)6(3)4 |
Proprietà del cloruro di solforile
Formula del cloruro di solforile
La formula chimica del dicloruro solforico è SO2Cl2. Deriva dalla combinazione di un atomo di zolfo, due atomi di ossigeno e due atomi di cloro. Questa formula rappresenta la composizione e la disposizione degli atomi in una molecola di dicloruro solforico.
Massa molare del cloruro di solforile
La massa molare del cloruro solforico può essere calcolata sommando le masse atomiche dei suoi elementi costitutivi. Il dicloruro solforico ha una massa molare di circa 134,97 grammi per mole. Questo valore è importante per vari calcoli di reazioni chimiche e stechiometria.
Punto di ebollizione del cloruro di solforile
Il bicloruro solforico ha un punto di ebollizione di circa 69 gradi Celsius. Quando la temperatura supera questo punto, il bicloruro solforico subisce un cambiamento di fase, passando da liquido a gassoso. Il punto di ebollizione è un parametro cruciale nel determinare le condizioni in cui il bicloruro solforico può essere utilizzato o manipolato.
Punto di fusione del cloruro di solforile
Il punto di fusione del dicloruro solforico è di circa -54 gradi Celsius. A temperature inferiori a questo punto, il dicloruro solforico passa dallo stato solido a quello liquido. Il punto di fusione è importante per lo stoccaggio e la manipolazione del dicloruro solforico perché indica le condizioni in cui si solidifica o liquefa.
Densità del cloruro di solforile g/mL
La densità del dicloruro solforico è di circa 1,638 grammi per millilitro (g/mL). La densità rappresenta la massa di una sostanza per unità di volume e aiuta a determinarne il comportamento fisico. La densità del dicloruro solforico è importante per comprenderne la galleggiabilità, la solubilità e la compatibilità con altre sostanze.
Peso molecolare del cloruro di solforile
Il peso molecolare del dicloruro solforico è di circa 134,97 unità di massa atomica (u). È la somma delle masse atomiche degli atomi costituenti una molecola di dicloruro solforico. Il peso molecolare fornisce informazioni cruciali per vari calcoli chimici e per determinare la quantità di sostanza in un dato campione.
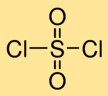
Struttura del cloruro di solforile
Il bicloruro solforico ha una struttura molecolare in cui un atomo di zolfo è legato due volte a due atomi di ossigeno e un legame singolo a due atomi di cloro. Questa disposizione forma un atomo di zolfo centrale circondato da atomi di ossigeno e cloro, conferendo al dicloruro solforico la sua struttura caratteristica.
Solubilità del cloruro di solforile
Il bicloruro solforico è scarsamente solubile in acqua. Reagisce con l’acqua per produrre acido cloridrico e acido solforico, rendendolo idroliticamente reattivo. Tuttavia, il dicloruro solforico mostra una certa solubilità in solventi organici come idrocarburi clorurati e composti aromatici, rendendoli adatti per determinate applicazioni.
| Aspetto | Liquido incolore |
| Peso specifico | 1.638 g/ml |
| Colore | N / A |
| Odore | Pungente, soffocante |
| Massa molare | 134,97 g/mole |
| Densità | 1.638 g/ml |
| Punto di fusione | -54°C |
| Punto di ebollizione | 69°C |
| Punto flash | N / A |
| solubilità in acqua | Reagisce vigorosamente |
| Solubilità | Solubile in solventi organici come idrocarburi clorurati e composti aromatici |
| Pressione del vapore | 43,6 mmHg (a 25°C) |
| Densità del vapore | 4.43 (aria = 1) |
| pKa | N / A |
| pH | N / A |
Sicurezza e pericoli del cloruro di solforile
Il bicloruro solforico presenta diversi rischi per la sicurezza e dovrebbero essere prese precauzioni quando lo si maneggia. È una sostanza corrosiva che può provocare gravi ustioni alla pelle, agli occhi e alle vie respiratorie per contatto. L’inalazione diretta dei suoi vapori può causare irritazione respiratoria e danni ai polmoni. Reagisce violentemente con l’acqua, liberando gas tossici e presentando rischio di esplosione. Pertanto, è importante maneggiare il dicloruro solforico in un’area ben ventilata e indossare dispositivi di protezione adeguati, come guanti, occhiali e protezione respiratoria. Le fuoriuscite devono essere pulite immediatamente utilizzando procedure appropriate e conservate in un’area fresca e asciutta, lontano da materiali incompatibili.
| Simboli di pericolo | Corrosivo (C), Ossidante (O) |
| Descrizione della sicurezza | Provoca gravi ustioni cutanee e lesioni oculari. Reagisce violentemente con l’acqua. |
| Numeri di identificazione delle Nazioni Unite | ONU 1834 (Bicloruro solforico) |
| Codice SA | 28121000 |
| Classe di pericolo | 8 (Sostanze corrosive) |
| Gruppo di imballaggio | II (Pericolo medio) |
| Tossicità | Molto tossico; Nocivo se ingerito, inalato o assorbito attraverso la pelle. |
Metodi per la sintesi del cloruro di solforile
Le persone usano comunemente alcuni metodi per sintetizzare il dicloruro solforico.
Un metodo prevede la reazione tra anidride solforosa (SO2) e cloro gassoso (Cl2) . In presenza di un catalizzatore, come carbone attivo o cloruro di alluminio, i gas reagiscono per formare dicloruro solforico (SO2Cl2). Questa reazione avviene generalmente a temperature elevate, intorno ai 100-200°C.
Un altro metodo per sintetizzare il dicloruro solforico prevede la reazione del triossido di zolfo (SO3) con acido cloridrico (HCl). In condizioni controllate, questi due composti si combinano per produrre dicloruro solforico. Questa reazione è esotermica e generalmente avviene in fase gassosa.
Il processo del cloruro di tionile genera dicloruro solforico mediante la reazione a temperatura ambiente dell’acido solforico (H2SO4) con il pentacloruro di fosforo (PCl5) . Questa reazione genera dicloruro solforico e sottoprodotti come acido fosforico (H3PO4) e acido cloridrico (HCl). Gli ambienti industriali utilizzano comunemente questo metodo.
È importante notare che questi metodi di sintesi richiedono un’attenta manipolazione dei reagenti e la considerazione di precauzioni di sicurezza a causa della reattività e della natura pericolosa delle sostanze coinvolte.
Inoltre, i chimici spesso utilizzano apparecchiature adeguate, come condensatori e sistemi a riflusso, per controllare le condizioni di reazione e garantire il successo della sintesi del dicloruro solforico.
Usi del cloruro di solforile
Il bicloruro solforico (SO2Cl2) trova varie applicazioni in diversi settori grazie alle sue proprietà uniche. Ecco alcuni usi chiave del cloruro solforico:
- Reagente chimico: la sintesi organica utilizza tipicamente il dicloruro solforico come reagente chimico versatile, dove partecipa attivamente a varie reazioni tra cui clorazione, solfonazione ed esterificazione, consentendo l’introduzione di funzionalità di cloro, zolfo o acido nei composti organici.
- Pesticidi e fumiganti: il dicloruro solforico agisce come un potente fumigante per controllare i parassiti nei cereali immagazzinati, nei mulini e negli impianti di lavorazione alimentare, eliminando attivamente insetti, larve e parassiti che possono danneggiare i prodotti agricoli immagazzinati grazie alle sue forti proprietà biocide.
- Polimerizzazione: nella polimerizzazione di monomeri specifici, come il cloruro di vinile, il dicloruro solforico funge da catalizzatore attivo o iniziatore, facilitando la produzione di cloruro di polivinile (PVC), un polimero termoplastico ampiamente utilizzato con applicazioni nell’industria edile, automobilistica ed elettrica.
- Prodotti farmaceutici: il dicloruro solforico svolge attivamente un ruolo cruciale nella sintesi di composti farmaceutici, in particolare sulfamidici, che sono antibiotici essenziali e agenti terapeutici utilizzati per trattare varie infezioni.
- Produzione di coloranti: il dicloruro solforico partecipa attivamente alla produzione di coloranti, in particolare quelli contenenti zolfo o cloro. Introduce attivamente i gruppi funzionali desiderati e migliora la solidità del colore e la stabilità del colorante.
- Intermedi chimici: il dicloruro solforico funge da intermedio attivo nella sintesi di altri prodotti chimici, tra cui anidride solforosa, acido solforico e cloruri di solfonile, che trovano applicazioni in molti settori come la produzione di detergenti, la produzione di materie plastiche e i prodotti farmaceutici.
- Trattamento dell’acqua: per la purificazione e la disinfezione dell’acqua, il bicloruro solforico neutralizza ed elimina attivamente batteri nocivi, virus e altri microrganismi presenti nelle fonti d’acqua.
- Applicazioni di laboratorio: diverse procedure di laboratorio utilizzano attivamente il dicloruro solforico, ad esempio per il rilevamento e la determinazione delle ammine primarie e secondarie. Reagisce attivamente con le ammine per formare sulfamidici stabili, facilitandone l’analisi e la caratterizzazione.
Domande:
D: Qual è il numero totale di grammi di molecole di SO2Cl2 in 13,5 g di cloruro di solforile?
R: Il numero totale di grammi di molecole di SO2Cl2 in 13,5 g di cloruro di solforile può essere calcolato dividendo la massa data per la massa molare di SO2Cl2.
D: SO2Cl2 è polare o non polare?
R: SO2Cl2 è una molecola polare a causa della presenza di legami polari e di una geometria molecolare asimmetrica.
D: Quando diminuirà la pressione di SO2Cl2?
R: La caduta di pressione di SO2Cl2 dipende da vari fattori come temperatura, volume e condizioni di reazione. Questo non può essere determinato solo in base al tempo.
D: Qual è la pressione parziale di SO2Cl2 in questa miscela?
R: La pressione parziale di SO2Cl2 in una miscela può essere determinata utilizzando la legge dei gas ideali, a seconda della temperatura, del volume e della frazione molare o della concentrazione di SO2Cl2.
D: Che tipo di forze intermolecolari sono previste tra le molecole di SO2Cl2?
R: Le forze intermolecolari previste tra le molecole di SO2Cl2 includono le interazioni dipolo-dipolo e le forze di dispersione di London.
D: A che punto la pressione parziale di SO2Cl2 diminuirà fino a un decimo del suo valore iniziale?
R: Il tempo necessario affinché la pressione parziale di SO2Cl2 diminuisca fino a un decimo del suo valore iniziale dipende dalle condizioni specifiche del sistema e dalla velocità della reazione chimica coinvolta.
D: Qual è la massa molare di SO2Cl2?
R: La massa molare di SO2Cl2 è di circa 134,97 grammi per mole.
D: Qual è la geometria molecolare di SO2Cl2?
R: La geometria molecolare di SO2Cl2 è curva o a forma di V, con un atomo di zolfo al centro legato a due atomi di ossigeno e due atomi di cloro.
D: Qual è la struttura di Lewis di SO2Cl2?
R: La struttura di Lewis di SO2Cl2 consiste in un atomo di zolfo doppiamente legato a un atomo di ossigeno e un legame singolo a un altro atomo di ossigeno, con due atomi di cloro legati all’atomo di zolfo.
