Il cloruro di potassio (KCl) è un composto contenente potassio e cloro. È usato come fertilizzante, additivo alimentare e trattamento medico per bassi livelli di potassio. Può essere utilizzato anche nelle iniezioni letali.
| Nome IUPAC | Cloruro di potassio |
| Formula molecolare | KCl |
| numero CAS | 7447-40-7 |
| Sinonimi | KCl, Kalium Chloratum, Muriato di potassio, Sylvite, Chloropotassuril, Kalitabs, Klotrix, Klor-Con, K-Dur |
| InChI | InChI=1S/ClH.K/h1H;/q;+1/p-1 |
Formula di cloruro di potassio
La formula chimica del cloruro di potassio è KCl. È un composto binario composto da un atomo di potassio e un atomo di cloro. La formula del cloruro di potassio è importante per comprenderne le proprietà chimiche e per eseguire calcoli relativi al suo utilizzo in varie applicazioni.
Massa molare del cloruro di potassio
La massa molare di KCl è 74,55 g/mol. È un solido cristallino bianco dal sapore salato e altamente solubile in acqua. KCl è un composto costituito da un atomo di potassio e un atomo di cloro.
Punto di ebollizione del cloruro di potassio
Il punto di ebollizione di KCl è 1.420 ° C (2.588 ° F). È un composto ad alto punto di fusione che richiede una notevole energia per raggiungere il punto di ebollizione. L’alto punto di ebollizione di KCl lo rende utile in applicazioni ad alta temperatura, come nella produzione di ceramica e vetro.
Punto di fusione di KCl
Il punto di fusione di KCl è 770°C (1.418°F). È un composto con punto di fusione relativamente alto che richiede calore significativo per sciogliersi. Il KCl viene utilizzato nella produzione di fertilizzanti e il suo elevato punto di fusione contribuisce a garantirne la stabilità alle alte temperature.
Densità KCl g/ml
La densità di KCl è 1,98 g/cm³. È un composto relativamente denso, il che significa che una piccola quantità contiene un gran numero di particelle. L’elevata densità di KCl lo rende utile in alcune applicazioni industriali, come nella produzione di fluidi di perforazione.
Peso molecolare di KCl
Il peso molecolare di KCl è 74,55 g/mol. È un composto relativamente leggero, il che significa che contiene un piccolo numero di particelle. Il basso peso molecolare del KCl lo rende facile da trasportare e maneggiare in ambienti industriali.
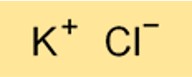
Struttura del KCl
La struttura di KCl è un reticolo cristallino ionico. Consiste nell’alternanza di ioni potassio e cloro disposti secondo uno schema ripetuto. La natura ionica della struttura fa sì che KCl sia un buon conduttore di elettricità quando disciolto in acqua.
| Aspetto | Solido cristallino bianco |
| Peso specifico | 1,98 g/cm³ |
| Colore | Da incolore a bianco |
| Odore | Inodore |
| Massa molare | 74,55 g/mole |
| Densità | 1,98 g/cm³ |
| Punto di fusione | 770°C (1.418°F) |
| Punto di ebollizione | 1420°C (2588°F) |
| Punto flash | Non applicabile |
| solubilità in acqua | 34,7 g/100 ml (0°C) |
| Solubilità | Solubile in acqua, glicerolo e formammide; leggermente solubile in etanolo |
| Pressione del vapore | Trascurabile |
| Densità del vapore | Non applicabile |
| pKa | -1,8 (acido coniugato) |
| pH | 7 (soluzione al 10%) |
Sicurezza e pericoli del cloruro di potassio
Il cloruro di potassio (KCl) presenta potenziali pericoli e problemi di sicurezza che dovrebbero essere considerati quando lo si maneggia o lo si utilizza. Ciò potrebbe causare irritazioni alla pelle e agli occhi e un’esposizione prolungata potrebbe provocare ustioni chimiche. L’inalazione di polvere di KCl può causare irritazione respiratoria e tosse. Inoltre, l’ingestione di grandi quantità di KCl può portare a squilibri elettrolitici e aritmie cardiache. È importante indossare dispositivi di protezione individuale adeguati, come guanti e protezione per gli occhi, e maneggiare il KCl in un’area ben ventilata. In caso di contatto con la pelle o con gli occhi è importante risciacquare abbondantemente la zona interessata ed eventualmente consultare un medico.
| Simboli di pericolo | Nessuno |
| Descrizione della sicurezza | Provoca irritazione alla pelle e agli occhi. Nocivo se ingerito. |
| UN ID | ONU1480 |
| Codice SA | 310420 |
| Classe di pericolo | 5.1 |
| Gruppo di imballaggio | II |
| Tossicità | LD50 (ratto, orale): 2.500 mg/kg |
Metodi di sintesi del cloruro di potassio
Diversi metodi possono sintetizzare il cloruro di potassio (KCl), tra cui:
- Solubilizzazione e cristallizzazione: questo metodo prevede la dissoluzione di KCl in acqua e quindi l’evaporazione della soluzione, lasciando dietro di sé cristalli solidi di KCl.
- Scambio ionico: per produrre KCl, gli ioni in una soluzione di un altro sale, come il cloruro di sodio, possono essere scambiati con ioni di potassio. Le industrie utilizzano comunemente questo metodo nella produzione di fertilizzanti KCl.
- Elettrolisi: l’elettrolisi di una soluzione di KCl produce potassio elementare e cloro gassoso, che si combinano per formare KCl.
- Reazione dell’idrossido di potassio con acido cloridrico : l’idrossido di potassio può reagire con acido cloridrico per produrre KCl e acqua.
- Reazione del carbonato di potassio con acido cloridrico: Il carbonato di potassio può reagire con l’acido cloridrico per produrre KCl, anidride carbonica e acqua.
Ciascun metodo presenta vantaggi e svantaggi e la scelta del metodo può dipendere da fattori quali la purezza richiesta del prodotto, la scala di produzione e il costo delle materie prime e delle attrezzature.
Usi del cloruro di potassio
Il cloruro di potassio ha una vasta gamma di usi, tra cui:
- Fertilizzante: utilizzato come fertilizzante per fornire nutrienti essenziali per la crescita delle piante.
- Additivo alimentare: utilizzato come sostituto del sale negli alimenti trasformati per ridurre l’assunzione di sodio.
- Trattamento dell’acqua: aggiunto ai sistemi di trattamento dell’acqua per prevenire la corrosione e la formazione di incrostazioni.
- Applicazioni mediche: utilizzato in fluidi endovenosi e soluzioni di reidratazione orale per sostituire gli elettroliti e trattare condizioni come l’ipokaliemia.
- Applicazioni industriali: utilizzato nella produzione di vetro, ceramica e saponi e come materia prima nella produzione di altri prodotti chimici.
- Mangime per animali: aggiunto al mangime per animali per fornire nutrienti essenziali.
- Agente antighiaccio: utilizzato come agente antighiaccio per sciogliere ghiaccio e neve su strade e marciapiedi.
- Perforazione di petrolio e gas: utilizzata come stabilizzante dell’argilla nelle operazioni di trivellazione di petrolio e gas.
- Reagente di laboratorio: utilizzato come reagente negli esperimenti e nelle analisi di laboratorio.
Domande:
D: Cos’è il cloruro di potassio?
R: Il cloruro di potassio (KCl) è un sale cristallino bianco composto da ioni potassio e cloro. Ha molte applicazioni in settori quali l’agricoltura, l’alimentazione, la medicina e la produzione chimica.
D: A cosa serve il cloruro di potassio?
R: Il cloruro di potassio è comunemente usato come fertilizzante, additivo alimentare e in applicazioni mediche per trattare condizioni come l’ipokaliemia. Può essere utilizzato anche nel trattamento delle acque, nei processi industriali, nell’alimentazione degli animali, nello sghiacciamento, nella perforazione di petrolio e gas ed esperimenti di laboratorio.
D: Il cloruro di potassio è sicuro?
R: Il cloruro di potassio può essere dannoso se ingerito in grandi quantità o se entra in contatto con gli occhi o la pelle. È importante seguire le linee guida e le normative di sicurezza adeguate durante la manipolazione o l’utilizzo del cloruro di potassio.
D: Il KCl è solubile in acqua?
R: Sì, KCl è altamente solubile in acqua. A temperatura ambiente, un grammo di KCl può sciogliersi in 1,5 ml di acqua.
D: KCl è ionico o covalente?
R: KCl è un composto ionico perché è composto da ioni potassio caricati positivamente e ioni cloruro caricati negativamente tenuti insieme da legami ionici.
D: KCl è un acido o una base?
R: Il cloruro di potassio è un composto neutro e non è né un acido né una base.
D: KCl è un elettrolita forte?
R: Sì, KCl è un elettrolita potente perché si dissocia completamente in ioni potassio e cloruro quando disciolto in acqua, consentendo la conduttività elettrica.
