Il cloruro di magnesio (MgCl2) è un composto composto da ioni magnesio e cloruro. È comunemente usato come integratore per trattare la carenza di magnesio e come antigelo per strade e marciapiedi.
| Nome IUPAC | Cloruro di magnesio |
| Formula molecolare | MgCl2 |
| numero CAS | 7786-30-3 |
| Sinonimi | Cloruro di magnesio, cloromagnesite, biscloromagnesio, cloruro di magnesio (II), E511, Nigari |
| InChI | InChI=1S/2ClH.Mg/h2*1H;/q;;+2/p-2 |
Formula di cloruro di magnesio
La formula chimica del cloruro di magnesio è MgCl2. Questa formula indica che il cloruro di magnesio è costituito da uno ione Mg+2 e due ioni Cl-. La formula è importante per determinare la quantità di cloruro di magnesio necessaria per le reazioni chimiche. Il cloruro di magnesio è comunemente usato come integratore per trattare la carenza di magnesio e come antigelo per strade e marciapiedi.
Massa molare del cloruro di magnesio
La massa molare del cloruro di magnesio è 95,21 g/mol. È un composto cristallino composto da uno ione Mg+2 e due ioni Cl-. La massa molare è una proprietà importante del cloruro di magnesio perché viene utilizzata per calcolare la quantità di sostanza nelle reazioni chimiche. Il cloruro di magnesio è comunemente usato come integratore per trattare la carenza di magnesio e come antigelo per strade e marciapiedi.
Punto di ebollizione di MgCl2
MgCl2 ha un punto di ebollizione elevato di 1.412°C, il che significa che richiede molta energia per rompere i legami tra i suoi atomi e le sue molecole. Questa proprietà lo rende utile in applicazioni ad alta temperatura, come nella produzione di metalli e leghe. MgCl2 viene utilizzato anche come essiccante per assorbire l’umidità dall’aria e come catalizzatore nelle reazioni chimiche.
Punto di fusione di MgCl2
Il punto di fusione di MgCl2 è 714°C, il che significa che è un solido a temperatura ambiente. Questa proprietà lo rende utile in varie applicazioni, come la produzione di magnesio metallico e come flusso nella saldatura dell’alluminio. MgCl2 viene utilizzato anche come coagulante nella produzione di tofu e altri prodotti a base di soia.
Densità MgCl2 g/ml
La densità di MgCl2 è 2,32 g/ml. Questa proprietà lo rende utile in varie applicazioni, come la produzione di materiali ritardanti di fiamma e il trattamento delle acque reflue. MgCl2 è utilizzato anche come abbattitore di polvere sulle strade e nella costruzione di autostrade.
Peso molecolare di MgCl2
Il peso molecolare di MgCl2 è 95,21 g/mol. Questa proprietà è importante per determinare la quantità di MgCl2 necessaria per le reazioni chimiche. MgCl2 è comunemente usato come integratore per trattare la carenza di magnesio e come antigelo per strade e marciapiedi.
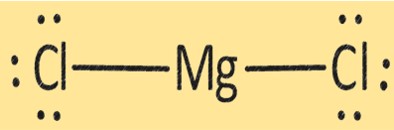
Struttura di MgCl2
MgCl2 ha una struttura cristallina composta da uno ione Mg+2 e due ioni Cl-. La struttura di MgCl2 è importante nel determinare le sue proprietà fisiche e chimiche. MgCl2 viene utilizzato in varie applicazioni, come la produzione di magnesio metallico, come essiccante e come coagulante nella produzione di tofu e altri prodotti a base di soia.
| Aspetto | Solido cristallino bianco |
| Peso specifico | 2,32 g/ml |
| Colore | Bianco |
| Odore | Inodore |
| Massa molare | 95,21 g/mole |
| Densità | 2,32 g/ml |
| Punto di fusione | 714°C |
| Punto di ebollizione | 1412°C |
| Punto flash | Non applicabile |
| solubilità in acqua | Molto solubile |
| Solubilità | Solubile in acqua, etanolo, metanolo |
| Pressione del vapore | Non applicabile |
| Densità del vapore | Non applicabile |
| pKa | 7,6 (per ioni Mg(H2O)6^2+) |
| pH | 6.0 – 8.0 |
Sicurezza e pericoli del cloruro di magnesio
Il cloruro di magnesio (MgCl2) è generalmente considerato sicuro se usato come indicato. Tuttavia, può comportare alcuni pericoli se non gestito correttamente. Può causare irritazione alla pelle e agli occhi e l’inalazione di polvere può causare problemi respiratori. L’ingestione di grandi quantità di MgCl2 può causare nausea, vomito e diarrea. Può anche essere dannoso per la vita acquatica se rilasciato nei corsi d’acqua. Quando si maneggia MgCl2 è necessario indossare dispositivi di protezione adeguati, come guanti e occhiali. Eventuali fuoriuscite o rilasci devono essere contenuti e ripuliti immediatamente per evitare danni ambientali.
| Simboli di pericolo | Nessuno assegnato |
| Descrizione della sicurezza | Evitare il contatto con la pelle e gli occhi. In caso di contatto, sciacquare con acqua. Indossare guanti e occhiali durante la manipolazione. |
| Numeri di identificazione delle Nazioni Unite | UNO 2019 |
| Codice SA | 28273100 |
| Classe di pericolo | 8 |
| Gruppo di imballaggio | III |
| Tossicità | LD50 (orale, ratto) – 4.640 mg/kg; LC50 (inalazione, ratto) – >4,4 mg/L per 4 ore |
Metodi di sintesi del cloruro di magnesio
Vari metodi possono sintetizzare MgCl2, inclusa la sintesi diretta, la reazione con acido cloridrico e la reazione con MgO.
Per produrre MgCl2 mediante sintesi diretta, bruciare il magnesio metallico nell’aria o nel cloro gassoso per creare MgO. Successivamente, fai reagire MgO con acido cloridrico per produrre MgCl2:
Mg + O2 → MgO
MgO + 2HCl → MgCl2 + H2O
Un altro metodo prevede la reazione del Mg metallico con acido cloridrico per produrre MgCl2 e idrogeno gassoso:
Mg + 2HCl → MgCl2 + H2
Per la reazione con MgO, mescoliamo MgO con acido cloridrico per produrre MgCl2 e acqua:
MgO + 2HCl → MgCl2 + H2O
La miscelazione di MgO con acido cloridrico produce cloruro di magnesio e acqua quando reagisce con MgO:
Mg(OH)2 + 2HCl → MgCl2 + 2H2O
Inoltre, possiamo ottenere MgCl2 come sottoprodotto del processo Solvay, che produce carbonato di sodio . Il processo porta alla produzione di cloruro di calcio e MgCl2 come sottoprodotti, che possono essere separati dalla soluzione di carbonato di sodio.
Usi del cloruro di magnesio
Il cloruro di magnesio ha una vasta gamma di usi in vari settori, tra cui:
- Agente antighiaccio: utilizzato come agente antighiaccio su strade e marciapiedi durante i mesi invernali grazie alla sua capacità di abbassare il punto di congelamento dell’acqua.
- Controllo della polvere: utilizzato come agente di controllo della polvere su strade non asfaltate e cantieri.
- Industria alimentare: utilizzato come coagulante nella produzione del tofu e come fonte di magnesio in alcuni prodotti alimentari.
- Medicina: usato in medicina come integratore per la carenza di magnesio e come trattamento per determinate condizioni, come costipazione e bruciore di stomaco.
- Agricoltura: utilizzato come fertilizzante e ammendante per migliorare il contenuto di magnesio del suolo e la crescita delle piante.
- Trattamento dell’acqua: utilizzato nei processi di trattamento dell’acqua per rimuovere le impurità e addolcire l’acqua dura.
- Applicazioni industriali: utilizzato nella produzione di prodotti tessili, carta e cemento, nonché in vari processi industriali.
- Salute e benessere: utilizzato in varie pratiche di salute e benessere, come il bagno, per favorire il rilassamento e migliorare la salute della pelle.
Domande:
D: Qual è la formula del cloruro di magnesio?
R: La formula del cloruro di magnesio è MgCl2.
D: Cos’è il cloruro di magnesio?
R: MgCl2 è un composto inorganico comunemente utilizzato in vari settori e applicazioni, tra cui come agente antighiaccio, agente di controllo della polvere e additivo alimentare.
D: Il cloruro di magnesio è solubile?
R: Sì, MgCl2 è solubile in acqua e altri solventi polari.
D: Il cloruro di magnesio è ionico o covalente?
R: MgCl2 è un composto ionico costituito da un catione (Mg2+) e un anione (Cl-).
D: Cos’è MgCl2?
R: MgCl2 è la formula chimica del cloruro di magnesio, un composto inorganico utilizzato in varie applicazioni industriali e di consumo.
D: Qual è l’equazione ionica netta per la reazione di MgCl2 con NaOH?
R: L’equazione ionica netta per la reazione di MgCl2 con NaOH è Mg2+ (aq) + 2OH- (aq) → Mg(OH)2 (s).
