Il cloruro di bario diidrato è un composto cristallino bianco con la formula chimica BaCl2·2H2O. È comunemente utilizzato in laboratorio come reagente e nell’industria per il trattamento delle superfici metalliche.
| Nome IUPAC | Cloruro di bario diidrato |
| Formula molecolare | BaCl2·2H2O |
| numero CAS | 10326-27-9 |
| Sinonimi | Bario dicloruro diidrato; Bario(II) cloruro diidrato; Cloruro di bario idrato (1:2:2); Cloruro di bario 2-idrato; Cloruro di bario diidrato; Cloruro di bario, diidrato; Cloruro di bario(2+) diidrato |
| InChI | InChI=1S/Ba.2ClH.2H2O/h;21H;21H2/q+2;;;/p-2 |
Massa molare BaCl2·2H2O
La massa molare del cloruro di bario diidrato (BaCl2·2H2O) è 244,26 g/mol. Questo valore può essere calcolato sommando le masse atomiche di ciascun elemento presente nel composto. Il bario ha una massa molare di 137,33 g/mol, il cloro ha una massa molare di 35,45 g/mol e l’idrogeno e l’ossigeno hanno masse molari di 1,01 g/mol e 16,00 g/mol, rispettivamente. Le due molecole d’acqua aggiungono altri 36,02 g/mol. La massa molare di BaCl2·2H2O è importante nei calcoli stechiometrici in cui la quantità di reagente o prodotto è espressa in moli.
Formula di cloruro di bario diidrato
La formula chimica del cloruro di bario diidrato è BaCl2·2H2O. Questa formula indica che ciascuna unità della formula del composto contiene uno ione bario, due ioni cloruro e due molecole d’acqua. La formula è importante per i calcoli stechiometrici e per comprendere le proprietà chimiche e fisiche del composto.
Punto di ebollizione del cloruro di bario diidrato
BaCl2·2H2O ha un punto di ebollizione di 1560°C. A questa temperatura il composto subirà una transizione di fase da liquido a gassoso. L’alto punto di ebollizione è dovuto alla natura ionica del composto, che richiede una grande quantità di energia per abbattere le forti forze elettrostatiche che tengono insieme gli ioni. BaCl2 · 2H2O è utilizzato nell’industria come agente di trattamento termico per superfici metalliche grazie ai suoi elevati punti di fusione e di ebollizione.
Punto di fusione del cloruro di bario diidrato
Il punto di fusione di BaCl2 · 2H2O è 962 °C. A questa temperatura il composto passerà dallo stato solido a quello liquido. L’alto punto di fusione di BaCl2·2H2O è dovuto ai forti legami ionici tra gli ioni bario e cloro, nonché ai legami idrogeno tra le molecole d’acqua. Il punto di fusione di BaCl2·2H2O è una proprietà importante per il suo utilizzo in varie applicazioni come la produzione di pigmenti e coloranti e il trattamento di superfici metalliche.
Densità del cloruro di bario diidrato g/ml
La densità del cloruro di bario diidrato è 3,097 g/cm³. Ciò significa che 1 cm³ di cloruro di bario diidrato pesa 3.097 grammi. La densità di una sostanza è una proprietà importante che può fornire informazioni sulle sue proprietà fisiche e chimiche. Nel caso del cloruro di bario diidrato, l’elevata densità è dovuta alla massa atomica relativamente grande del bario e allo stretto impaccamento di ioni nella struttura del reticolo cristallino.
Peso molecolare BaCl2 · 2H2O
Il peso molecolare di BaCl2·2H2O è 244,26 g/mol. Questo valore può essere calcolato sommando i pesi atomici di ciascun elemento presente nel composto. Il peso molecolare è una proprietà importante di BaCl2 · 2H2O perché viene utilizzato in varie applicazioni come la produzione di pigmenti e coloranti e come reagente negli esperimenti di laboratorio.
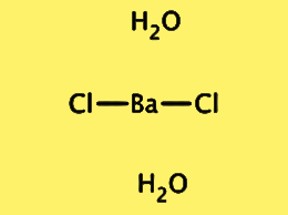
Struttura BaCl2·2H2O
La struttura cristallina di BaCl2·2H2O è ortorombica, con il gruppo spaziale Pnma. La cella unitaria contiene un’unità con la formula BaCl2·2H2O, composta da uno ione bario, due ioni cloruro e due molecole d’acqua. Lo ione bario è circondato da otto ioni cloruro e le molecole d’acqua sono legate idrogeno agli ioni cloruro. La struttura cristallina di BaCl2 · 2H2O è importante per comprenderne le proprietà fisiche e chimiche, nonché il suo utilizzo in varie applicazioni.
| Aspetto | Solido cristallino bianco |
| Peso specifico | 3.097 g/cm³ |
| Colore | Da incolore a bianco |
| Odore | Inodore |
| Massa molare | 244,26 g/mole |
| Densità | 3.097 g/cm³ |
| Punto di fusione | 962°C |
| Punto di ebollizione | 1560°C |
| Punto flash | Non applicabile |
| solubilità in acqua | 31,2 g/100 ml (a 20°C) |
| Solubilità | Solubile in alcool e acetone |
| Pressione del vapore | Non applicabile |
| Densità del vapore | Non applicabile |
| pKa | Non applicabile |
| pH | Neutro (7) |
Nota: la tabella potrebbe non essere allineata correttamente a seconda delle impostazioni di visualizzazione della piattaforma o del dispositivo in uso.
Sicurezza e pericoli del cloruro di bario diidrato
BaCl2 · 2H2O comporta numerosi rischi per la sicurezza e la salute, che possono essere dannosi se non gestiti correttamente. È una sostanza corrosiva che può provocare gravi ustioni alla pelle e agli occhi al contatto. L’inalazione delle sue polveri o vapori può causare problemi respiratori e danni ai polmoni. È anche tossico se ingerito e può causare problemi gastrointestinali. BaCl2 · 2H2O deve essere maneggiato con cautela e quando si lavora con il composto è necessario indossare dispositivi di protezione adeguati come guanti, occhiali e respiratori. Dovrebbe essere conservato lontano da sostanze incompatibili e in un’area sicura per prevenire l’esposizione accidentale. In caso di emergenza, consultare immediatamente un medico.
| Simboli di pericolo | Corrosivo (C) | |
| Descrizione della sicurezza | ||
| Identificatori AN | UN1564 | |
| Codice SA | 28273990 | |
| Classe di pericolo | 8 | |
| Gruppo di imballaggio | III | |
| Tossicità | Tossico se ingerito; può causare problemi gastrointestinali. Corrosivo per la pelle e gli occhi. L’inalazione di polvere o vapori può causare problemi respiratori e danni ai polmoni. | |
Metodi per la sintesi del cloruro di bario diidrato
Puoi sintetizzare BaCl2 · 2H2O con diversi metodi.
Un metodo comune consiste nel far reagire il carbonato di bario o l’idrossido di bario con acido cloridrico. È necessario evaporare la soluzione risultante per ottenere il composto solido.
Un altro metodo consiste nel far reagire il solfuro di bario con acido cloridrico. Questa reazione produce gas di idrogeno solforato, che è necessario smaltire correttamente. La soluzione ottenuta viene poi purificata mediante filtrazione e cristallizzazione per ottenere il prodotto finale.
Puoi anche sintetizzare BaCl2 · 2H2O mediante una reazione di precipitazione utilizzando cloruro di sodio e nitrato di bario. È necessario mescolare i due composti in una soluzione, quindi filtrare ed essiccare il precipitato risultante per ottenere il composto solido.
Inoltre, BaCl2 · 2H2O può essere sintetizzato mediante la reazione dell’ossido di bario con acido cloridrico. Questa reazione produce acqua come sottoprodotto, che è necessario rimuovere tramite evaporazione. La soluzione ottenuta viene poi cristallizzata per ottenere il prodotto finale.
Quando si lavora con BaCl2 · 2H2O, è necessario prendere le opportune precauzioni di sicurezza poiché è un composto corrosivo e tossico. È necessario indossare dispositivi di protezione come guanti, occhiali e respiratori e maneggiare il composto in un’area ben ventilata.
Usi del cloruro di bario diidrato
BaCl2 · 2H2O ha diversi usi in vari settori.
- L’industria chimica utilizza BaCl2 · 2H2O come reagente in numerose reazioni chimiche, come la produzione di sali di bario, pigmenti e ceramiche.
- Funziona come un flusso nella raffinazione dei metalli e come catalizzatore nella sintesi organica.
- L’industria medica utilizza BaCl2 · 2H2O come agente di contrasto in radiografia e per trattare l’avvelenamento da bario. Viene utilizzato anche nella produzione di cementi dentali.
- L’industria tessile utilizza BaCl2·2H2O come mordente, una sostanza che lega i coloranti alle fibre, e come ritardante di fiamma per i tessili.
- Nell’industria petrolifera, BaCl2 · 2H2O viene utilizzato come additivo nel fango di perforazione per aumentare la densità del fango e prevenire scoppi durante le operazioni di perforazione.
- L’industria alimentare utilizza BaCl2 · 2H2O come conservante e esaltatore di sapidità per alcuni alimenti.
Per ridurre al minimo i rischi associati al lavoro con il corrosivo e tossico BaCl2 · 2H2O, è necessario adottare adeguate precauzioni di sicurezza, come indossare dispositivi di protezione e maneggiare il composto in un’area ben ventilata.
Domande:
Qual è la formula del cloruro di bario diidrato?
La formula del cloruro di bario diidrato è BaCl2·2H2O.
Il cloruro di bario diidrato è solubile in acqua?
Sì, il cloruro di bario diidrato è altamente solubile in acqua. Si dissolve facilmente in acqua, con una solubilità di circa 31,2 g/100 mL a temperatura ambiente. Questa elevata solubilità lo rende un composto utile in vari settori, come nella produzione di sali di bario e come additivo per i fanghi di perforazione nell’industria petrolifera. Tuttavia, la sua elevata solubilità significa anche che può rappresentare un rischio per la salute umana e l’ambiente se non maneggiato correttamente, poiché può contaminare le fonti d’acqua e causare tossicità per gli organismi acquatici. Pertanto, è necessario adottare precauzioni adeguate quando si lavora con BaCl2 · 2H2O per evitare la contaminazione e garantire una manipolazione sicura.
