Il cloruro di ammonio o NH4Cl è un sale cristallino bianco utilizzato in varie applicazioni, tra cui medicine e fertilizzanti. Si forma dalla reazione di ammoniaca e acido cloridrico e ha un distinto sapore salato.
| Nome IUPAC | Cloruro d’ammonio |
| Formula molecolare | NH4Cl |
| numero CAS | 12125-02-9 |
| Sinonimi | Sale ammoniaca, Salmiac, Sale di Nushadir, Amcloro, Sal armagnac, Cloridrato, Ammonio muriato, Sal armagnac |
| InChI | InChI=1S/ClH.H3N/h1H;1H3 |
Massa molare di NH4Cl
Il cloruro di ammonio ha una massa molare di 53,49 g/mol. La massa molare si riferisce alla massa di una mole di una sostanza ed è espressa in grammi per mole (g/mol). La massa molare del cloruro di ammonio viene determinata aggiungendo le masse atomiche dei suoi atomi costituenti, che sono azoto (N), idrogeno (H) e cloro (Cl). La formula molecolare del cloruro di ammonio è NH4Cl, il che significa che contiene un atomo di azoto, quattro atomi di idrogeno e un atomo di cloro. Pertanto, la massa molare del cloruro di ammonio può essere calcolata come segue
Massa molare = (1 x massa atomica di N) + (4 x massa atomica di H) + (1 x massa atomica di Cl)
= (1 x 14,01 g/mol) + (4 x 1,01 g/mol) + (1 x 35,45 g/mol)
= 53,49 g/mole
Punto di ebollizione del cloruro di ammonio
Il punto di ebollizione del cloruro di ammonio è 520°C (968°F). Il punto di ebollizione è la temperatura alla quale la tensione di vapore di un liquido eguaglia la pressione esterna ad esso applicata. A questa temperatura, il cloruro di ammonio evapora e si trasforma in uno stato gassoso. L’alto punto di ebollizione del cloruro di ammonio è dovuto ai suoi forti legami ionici tra gli ioni ammonio (NH4+) e cloruro (Cl-).
Punto di fusione del cloruro di ammonio
Il punto di fusione del cloruro di ammonio è 338°C (640°F). Il punto di fusione è la temperatura alla quale un solido si trasforma in un liquido. A questa temperatura, i legami ionici tra gli ioni ammonio (NH4+) e cloruro (Cl-) si rompono e il cloruro di ammonio cambia da solido a liquido. Il cloruro di ammonio ha un punto di fusione relativamente basso rispetto ad altri composti ionici, rendendolo utile in alcune applicazioni come la saldatura e la metallurgia.
Densità del cloruro di ammonio g/ml
La densità del cloruro di ammonio è 1.527 g/cm³. La densità è una misura della quantità di massa per unità di volume di una sostanza. L’elevata densità del cloruro di ammonio è dovuta alla sua struttura reticolare ionica molto compatta. Il cloruro di ammonio ha una densità maggiore dell’acqua, il che significa che affonderà nell’acqua.
Peso molecolare del cloruro di ammonio
Il peso molecolare del cloruro di ammonio è 53,49 g/mol. Il peso molecolare è la somma dei pesi atomici di tutti gli atomi presenti in una molecola. Il peso molecolare del cloruro di ammonio è uguale alla sua massa molare.
Struttura del cloruro di ammonio
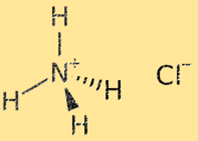
La struttura del cloruro di ammonio è un reticolo cristallino composto da ioni ammonio (NH4+) e cloruro (Cl-) alternati. Lo ione ammonio è uno ione poliatomico con carica positiva (+1), costituito da un atomo di azoto e quattro atomi di idrogeno. Lo ione cloruro è uno ione monoatomico con carica negativa (-1), costituito da un atomo di cloro. La struttura del reticolo cristallino del cloruro di ammonio è stabilizzata da forti legami ionici tra gli ioni ammonio e cloruro, risultando in un solido molto stabile e fragile.
Formula di cloruro di ammonio
La formula del cloruro di ammonio è NH4Cl. È composto da uno ione ammonio (NH4+) e uno ione cloruro (Cl-). La formula rappresenta il rapporto tra gli atomi in una molecola e mostra che per ogni ione ammonio esiste uno ione cloruro. La formula del cloruro di ammonio viene utilizzata per determinare la massa molare, la densità e altre proprietà del composto.
| Aspetto | Solido cristallino bianco |
| Peso specifico | 1.527 g/cm³ |
| Colore | Da incolore a bianco |
| Odore | Inodore |
| Massa molare | 53,49 g/mole |
| Densità | 1.527 g/cm³ |
| Punto di fusione | 338°C (640°F) |
| Punto di ebollizione | 520°C (968°F) |
| Punto flash | Non applicabile |
| solubilità in acqua | 29,7 g/100 ml (25°C) |
| Solubilità | Solubile in etanolo e acetone |
| Pressione del vapore | Non applicabile |
| Densità del vapore | Non applicabile |
| PKa | 9:25 |
| pH | 4,6 (soluzione al 5%) |
Sicurezza e pericoli del cloruro di ammonio
Il cloruro di ammonio (NH4Cl) è generalmente considerato sicuro per l’uso normale. Tuttavia può essere dannoso se ingerito o inalato in grandi quantità. L’ingestione di NH4Cl può causare irritazione alla bocca e alla gola, nausea, vomito e diarrea. L’inalazione di NH4Cl può causare irritazione del sistema respiratorio, tosse e mancanza di respiro. NH4Cl deve essere maneggiato con cura, poiché può causare irritazione alla pelle e agli occhi. È inoltre importante evitare l’esposizione alla polvere o ai vapori di NH4Cl, che possono essere irritanti per gli occhi, il naso e la gola. Quando si maneggia NH4Cl è necessario indossare dispositivi di protezione individuale adeguati, come guanti e occhiali.
| Simboli di pericolo | XI |
| Descrizione della sicurezza | S22, S24/25, S36/37/39 |
| Numeri di identificazione delle Nazioni Unite | ONU 3077 |
| Codice SA | 2827.10.00 |
| Classe di pericolo | 9 – Merci pericolose varie |
| Gruppo di imballaggio | III |
| Tossicità | Bassa tossicità, ma può essere dannoso se ingerito o inalato in grandi quantità. |
Metodi per la sintesi del cloruro di ammonio
Il cloruro di ammonio (NH4Cl) può essere sintetizzato con vari metodi.
- Un metodo comune consiste nel far reagire il gas di ammoniaca con acido cloridrico in acqua. Questa reazione esotermica produce NH4Cl sotto forma di un solido cristallino bianco. È importante aggiungere lentamente l’acido cloridrico all’acqua mescolando per evitare schizzi dovuti al calore generato.
- Un altro metodo per produrre NH4Cl è come sottoprodotto di vari processi industriali come la produzione di carbonato di sodio o il processo Solvay.
- Un altro modo per sintetizzare NH4Cl è far reagire l’ammoniaca con il cloruro di sodio. Questa reazione produce sia NH4Cl che idrossido di sodio. Questa reazione è esotermica e richiede un attento controllo per evitare la formazione di sottoprodotti indesiderati.
Usi del cloruro di ammonio
Il cloruro di ammonio (NH4Cl) ha molti usi in diversi settori.
- NH4Cl funge da fertilizzante in agricoltura, fornendo nutrienti essenziali alle colture come azoto e cloruro, migliorando così la resa e la qualità.
- Il cloruro di ammonio facilita il corretto funzionamento delle celle a secco conducendo elettricità come elettrolita.
- L’industria tessile utilizza NH4Cl come agente di tintura e stampa, che aiuta a fissare i coloranti sui tessuti e a migliorare la solidità del colore.
- Come flusso nella lavorazione dei metalli e nella saldatura, NH4Cl rimuove gli strati di ossido dai metalli, consentendo una saldatura più semplice.
- La sostanza chimica ha applicazioni nel settore alimentare, farmaceutico e cosmetico come agente aromatizzante, espettorante nei medicinali per la tosse e ingrediente nei prodotti per la cura personale.
Nel complesso, le proprietà uniche di NH4Cl lo rendono una sostanza chimica versatile con molte importanti applicazioni in diversi settori.
Domande:
D: Il cloruro di ammonio è sublime?
R: Sì, è noto che il cloruro di ammonio sublima, il che significa che può passare direttamente dalla fase solida a quella gassosa senza sciogliersi nel mezzo.
D: NH4Cl è acido o basico?
R: Il cloruro di ammonio è un sale acido. Quando disciolto in acqua, può subire idrolisi per produrre una soluzione acida. Questo perché lo ione ammonio agisce come un acido debole e dona un protone (H+) alle molecole d’acqua.
D: Qual è la formula del cloruro di ammonio?
R: La formula del cloruro di ammonio è NH4Cl. È composto da uno ione ammonio (NH4+) e uno ione cloruro (Cl-) tenuti insieme da legami ionici.
D: Il cloruro di ammonio si dissolve in acqua?
R: Sì, il cloruro di ammonio è altamente solubile in acqua. A temperatura ambiente, in 100 ml di acqua si possono sciogliere circa 29,7 grammi di cloruro di ammonio.
D: Come separare il cloruro di ammonio e il cloruro di sodio?
R: Un modo per separare il cloruro di ammonio e il cloruro di sodio è la sublimazione. Ciò può essere ottenuto riscaldando la miscela, provocando la sublimazione del cloruro di ammonio mentre il cloruro di sodio rimane in forma solida. Il cloruro di ammonio sublimato può quindi essere raccolto e ricondensato in una forma solida. Un altro metodo consiste nel sciogliere la miscela in acqua e quindi far precipitare selettivamente uno dei sali utilizzando un reagente specifico o un aggiustamento del pH.
