Il clorato di potassio (KClO3) è un composto chimico composto da potassio, cloro e ossigeno. È comunemente usato nella fabbricazione di fiammiferi, esplosivi e fuochi d’artificio grazie alle sue proprietà ossidanti.
| Nome IUPAC | Cloruro di potassio |
| Formula molecolare | KClO3 |
| numero CAS | 3811-04-9 |
| Sinonimi | Clorato di potassio, Clorkalico, Clorato di potassio, Perclorato di potassio, UN 1485, Clorato di potassio, Kalium percloricum |
| InChI | InChI=1S/ClH3KO3/c2-1(3)4/h(H3,2,3,4)/p-1 |
Proprietà del clorato di potassio
Formula di clorato di potassio
Il clorato di potassio ha una formula chimica KClO3, che indica che è costituito da un atomo di potassio, un atomo di cloro e tre atomi di ossigeno. È un composto ionico che si forma quando gli ioni K+ e ClO3- si combinano tramite un legame ionico. Il composto è molto reattivo a causa della presenza di ossigeno, conferendogli forti proprietà ossidanti.
Massa molare del clorato di potassio
La massa molare di KClO3 è 122,55 g/mol. È la somma delle masse atomiche dei singoli elementi che compongono il composto, ovvero potassio, cloro e ossigeno. La massa molare è un parametro importante in chimica perché viene utilizzato per calcolare la massa di una sostanza necessaria per produrre una certa quantità di prodotto in una reazione chimica.
Punto di ebollizione del clorato di potassio
KClO3 non ha un punto di ebollizione ben definito poiché si decompone prima di raggiungere il punto di ebollizione. Quando riscaldato, si decompone in cloruro di potassio e ossigeno gassoso. Pertanto, KClO3 subisce una reazione di decomposizione termica anziché un punto di ebollizione.
Clorato di potassio Punto di fusione
Il punto di fusione di KClO3 è 356°C (673°F). A questa temperatura il composto solido si scioglie e si trasforma in un liquido. Il punto di fusione è una proprietà essenziale di un composto perché influenza il comportamento fisico della sostanza, comprese la sua solubilità e densità.
Densità del clorato di potassio g/mL
La densità di KClO3 è 2,32 g/mL a temperatura ambiente. Ciò significa che un volume specifico del composto ha una certa massa, utile per determinare la massa di una sostanza necessaria per una particolare reazione chimica. La densità di KClO3 influenza anche la sua solubilità in acqua, poiché i composti con densità maggiore tendono ad essere meno solubili in acqua.
Peso molecolare del clorato di potassio
Il peso molecolare di KClO3 è 122,55 g/mol. È la somma dei pesi atomici dei suoi atomi costituenti, vale a dire potassio, cloro e ossigeno. Il peso molecolare è un parametro essenziale nella stechiometria perché viene utilizzato per calcolare le quantità di reagenti e prodotti in una reazione chimica.
Struttura del clorato di potassio
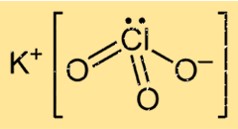
KClO3 ha una struttura cristallina nella sua forma solida, costituita da atomi di potassio, cloro e ossigeno disposti secondo uno schema specifico. Il composto forma una struttura reticolare cristallina cubica centrata sulla faccia, in cui ciascuno ione di potassio è circondato da sei atomi di ossigeno e ciascuno ione di ossigeno è circondato da quattro atomi di potassio e due atomi di cloro.
Solubilità del clorato di potassio
KClO3 è moderatamente solubile in acqua, con una solubilità di 7 g/100 ml di acqua a temperatura ambiente. La solubilità del composto aumenta con la temperatura, perché le molecole d’acqua hanno più energia cinetica e possono dissolvere una maggiore quantità di composto. KClO3 è solubile anche in altri solventi polari come etanolo e acetone.
| Aspetto | Solido cristallino bianco |
| Peso specifico | 2,32 g/cm³ |
| Colore | Bianco |
| Odore | Inodore |
| Massa molare | 122,55 g/mole |
| Densità | 2,32 g/cm³ |
| Punto di fusione | 356°C (673°F) |
| Punto di ebollizione | Si rompe prima dell’ebollizione |
| Punto flash | Non applicabile |
| solubilità in acqua | 7 g/100 ml a 20°C |
| Solubilità | Solubile in etanolo e acetone |
| Pressione del vapore | Non applicabile |
| Densità del vapore | Non applicabile |
| pKa | 1,8 (Ka = 1,6 × 10⁻⁵) |
| pH | Il pH di una soluzione 0,1 M è compreso tra circa 6,5 e 7,5 |
Sicurezza e pericoli del clorato di potassio
Il KClO3 è una sostanza altamente reattiva e potenzialmente pericolosa, pertanto deve essere maneggiata con estrema cautela. Può causare gravi irritazioni alla pelle e agli occhi e può essere tossico se ingerito o inalato. Se riscaldato, può reagire violentemente e persino esplodere. Il KClO3 può anche reagire fortemente con altri prodotti chimici, come l’acido solforico e i composti organici, e produrre gas tossici come il cloro e il biossido di clorato. È importante seguire protocolli di sicurezza adeguati quando si lavora con KClO3, incluso indossare dispositivi di protezione e lavorare in un’area ben ventilata.
| Simboli di pericolo | O, Xi, N |
| Descrizione della sicurezza | Evitare il contatto con materiali combustibili. Tossico se ingerito. Provoca gravi ustioni cutanee e lesioni oculari. |
| Numeri di identificazione delle Nazioni Unite | UN1485 |
| Codice SA | 2829.90.10 |
| Classe di pericolo | 5.1 |
| Gruppo di imballaggio | II |
| Tossicità | Molto tossico |
Metodi di sintesi del clorato di potassio
Esistono diversi metodi per sintetizzare KClO3.
Un metodo prevede la reazione tra cloruro di potassio e candeggina. Questo metodo prevede l’aggiunta di una soluzione di candeggina a una soluzione di cloruro di potassio e l’agitazione della miscela. Per dare KClO3 filtrare e lavare il precipitato ottenuto.
Un altro metodo prevede l’elettrolisi di una soluzione contenente cloruro di potassio , acqua e una fonte di ossigeno. Una cella elettrolitica, un dispositivo specializzato, esegue questo processo separando gli ioni potassio e cloruro e producendo ossigeno gassoso. L’ossigeno reagisce con gli ioni potassio per formare KClO3.
Un terzo metodo prevede la reazione tra idrossido di potassio e cloro gassoso, che produce KClO3 con cloruro di potassio e acqua. Questo metodo richiede un attento controllo della temperatura e della concentrazione dei reagenti per garantire rese ottimali.
Usi del clorato di potassio
KClO3 ha un’ampia gamma di usi in vari settori, tra cui:
- Prodotti pirotecnici: comunemente usati come agente ossidante nei fuochi d’artificio e altri dispositivi pirotecnici.
- Fiammiferi: utilizzati nelle teste dei fiammiferi di sicurezza, che si accendono se colpiti contro una superficie ruvida.
- Fertilizzante: utilizzato come fonte di potassio per i fertilizzanti vegetali.
- Candeggina: utilizzata come agente sbiancante per tessuti, carta e altri materiali.
- Reagente di laboratorio: utilizzato anche come reagente di laboratorio per varie reazioni chimiche.
- Applicazioni mediche: usato in medicina per trattare alcuni tipi di condizioni della pelle, come l’eczema.
- Esplosivi: un ingrediente comune in alcuni tipi di esplosivi, come detonatori e dinamite.
- Ossidante: utilizzato come agente ossidante nella produzione di alcuni prodotti chimici, come i perclorati.
Domande:
D: Quanti grammi di cloruro di potassio vengono prodotti se 25 g di clorato di potassio si decompongono?
R: Quando 25 g di KClO3 si decompongono, producono 13,47 g di cloruro di potassio.
D: Come produrre il clorato di potassio?
R: Il KClO3 può essere prodotto facendo reagire il cloruro di potassio con la candeggina, mediante elettrolisi di una soluzione contenente cloruro di potassio o facendo reagire l’idrossido di potassio con cloro gassoso.
D: Quante moli di ossigeno vengono prodotte quando 2 moli di clorato di potassio (kclo3) si decompongono?
R: Quando 2 moli di KClO3 si decompongono, producono 3 moli di gas ossigeno.
D: Una soluzione da 0,70 m contiene 3,0 g di clorato di potassio (kclo3). Qual è il volume della soluzione?
R: Il volume della soluzione da 0,70 m contenente 3,0 g di KClO3 è 51,4 mL.
D: Il clorato di potassio è volatile?
R: KClO3 non è considerata una sostanza volatile perché ha un punto di fusione e di ebollizione relativamente alto.
D: Quante kcl vengono prodotte se si decompongono 2,50 g di kclo3?
R: Quando 2,50 g di KClO3 si decompongono, producono 1,35 g di cloruro di potassio.
D: Kclo3 è solubile in acqua?
R: Sì, KClO3 è altamente solubile in acqua, con una solubilità di 7 g/100 mL a temperatura ambiente.
D: Quanti grammi di ossigeno possono essere prodotti dalla decomposizione di 100 g di kclo3?
R: Quando 100 g di KClO3 si decompongono, producono 45,02 g di ossigeno gassoso.
