Il clorato di calcio (Ca(ClO3)2) è un composto chimico composto da calcio, cloro e ossigeno. È comunemente usato come agente ossidante nei fuochi d’artificio e nei fiammiferi. Può essere utilizzato anche per sterilizzare le apparecchiature dell’industria alimentare.
| Nome IUPAC | Clorato di calcio |
| Formula molecolare | Ca(ClO3)2 |
| numero CAS | 10137-74-3 |
| Sinonimi | Acido clorico, sale di calcio; Clorato di calcio idrato; Perclorato di calcio; Calcioclorito; UN1456 |
| InChI | InChI=1S/Ca.2ClHO3/c;2 2-1(3)4/h;2 (H,2,3,4)/q+2;;/p-2 |
Proprietà del clorato di calcio
Formula del clorato di calcio
La formula del clorato di calcio è Ca(ClO3)2. È composto da uno ione Ca2+ e due ioni ClO3-. Il clorato di calcio è un composto ionico, il che significa che è tenuto insieme dall’attrazione elettrostatica tra ioni positivi e negativi.
Massa molare del clorato di calcio
La massa molare di Ca(ClO3)2 è 206,98 g/mol. Questo può essere calcolato sommando le masse atomiche di calcio, cloro e ossigeno che compongono il composto. La massa molare è importante per calcolare la quantità di Ca(ClO3)2 necessaria per una determinata reazione.
Punto di ebollizione del clorato di calcio
Ca(ClO3)2 non ha un punto di ebollizione perché si decompone prima di raggiungere il punto di ebollizione. Quando riscaldato, Ca(ClO3)2 si decompone in cloruro di calcio (CaCl2) e ossigeno gassoso (O2). Questa decomposizione è esotermica e può essere pericolosa se non gestita correttamente.
Clorato di calcio Punto di fusione
Il punto di fusione di Ca(ClO3)2 è 135°C. Questa è la temperatura alla quale il composto solido cambia da solido a liquido. Ca(ClO3)2 è un solido cristallino bianco a temperatura e pressione ambiente.
Densità del clorato di calcio g/mL
La densità di Ca(ClO3)2 è 2,4 g/mL. Ciò significa che un millilitro di Ca(ClO3)2 pesa 2,4 grammi. La densità è una misura della densità delle molecole in una sostanza. Ca(ClO3)2 è più denso dell’acqua, che ha una densità di 1 g/mL.
Peso molecolare del clorato di calcio
Il peso molecolare di Ca(ClO3)2 è 206,98 g/mol. È uguale alla massa molare e può essere calcolata sommando i pesi atomici dei singoli elementi del composto.
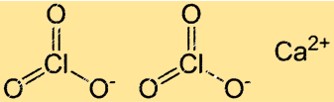
Struttura del clorato di calcio
Ca(ClO3)2 ha una struttura reticolare cristallina tipica dei composti ionici. In questa struttura, gli ioni Ca2+ e ClO3- sono disposti secondo uno schema regolare e ripetuto. Ogni ione Ca2+ è circondato da sei ioni ClO3- e ogni ione clorato è circondato da sei ioni calcio.
Solubilità del clorato di calcio
Ca(ClO3)2 è solubile in acqua e forma una soluzione limpida e incolore. La solubilità di Ca(ClO3)2 in acqua aumenta con la temperatura. Tuttavia, è meno solubile in solventi organici come etanolo e acetone. Anche il Ca(ClO3)2 è igroscopico, ovvero assorbe l’umidità dall’aria. Questo può rendere il composto bagnato o dissolversi nel tempo.
| Aspetto | Solido cristallino bianco |
| Peso specifico | 2.4 |
| Colore | Incolore |
| Odore | Inodore |
| Massa molare | 206,98 g/mole |
| Densità | 2,4 g/ml |
| Punto di fusione | 135°C |
| Punto di ebollizione | Si decompone prima del punto di ebollizione |
| Punto flash | Non applicabile |
| solubilità in acqua | Solubile |
| Solubilità | Solubile in acqua, meno solubile in solventi organici |
| Pressione del vapore | Non applicabile |
| Densità del vapore | Non applicabile |
| pKa | Non applicabile |
| pH | Non applicabile |
Sicurezza e pericoli del clorato di calcio
Ca(ClO3)2 è considerata una sostanza pericolosa e deve essere maneggiata con cura. È un agente ossidante che può reagire violentemente con i materiali organici, provocando incendi ed esplosioni. L’inalazione o l’ingestione di Ca(ClO3)2 può causare irritazione respiratoria e gastrointestinale. L’esposizione prolungata può causare irritazioni alla pelle, ustioni e possibili reazioni allergiche. È importante indossare dispositivi di protezione individuale adeguati quando si maneggia Ca(ClO3)2, inclusi guanti, occhiali e un respiratore. In caso di esposizione, consultare immediatamente un medico. Conservare Ca(ClO3)2 in un luogo fresco, asciutto e ben ventilato, lontano da sostanze incompatibili.
| Simboli di pericolo | O, Xn |
| Descrizione della sicurezza | Tenere lontano da materiali organici. Indossare dispositivi di protezione individuale. Conservare in un luogo fresco, asciutto e ben ventilato. |
| Numeri di identificazione delle Nazioni Unite | UN1458 |
| Codice SA | 2829.11.00 |
| Classe di pericolo | 5.1 |
| Gruppo di imballaggio | II |
| Tossicità | Tossico se ingerito o inalato. Può causare irritazione alla pelle e agli occhi. Può causare irritazione respiratoria. |
Metodi di sintesi del clorato di calcio
Per sintetizzare Ca(ClO3)2, possiamo utilizzare diversi metodi.
Un metodo comune prevede la reazione dell’idrossido di calcio con cloro gassoso. In questo processo, come sottoprodotto si forma prima il cloruro di calcio, che reagisce con il cloro rimanente per formare Ca(ClO3)2.
Un altro metodo prevede la reazione del carbonato di calcio con acido nitrico e cloro gassoso. Per ottenere Ca(ClO3)2, la soluzione ottenuta viene evaporata e cristallizzata.
Un altro approccio prevede l’elettrolisi di una soluzione contenente cloruro di calcio e clorato di sodio. Questo processo produce Ca(ClO3)2 e cloruro di sodio come prodotti finali.
La reazione tra ipoclorito di calcio e clorato di sodio produce Ca(ClO3)2, che viene poi purificato e cristallizzato.
Usi del clorato di calcio
Ca(ClO3)2 ha diversi usi importanti in vari settori. Ecco alcune delle applicazioni più comuni di Ca(ClO3)2:
- Candeggina: utilizzata come agente sbiancante nell’industria della pasta di legno e della carta.
- Fuochi d’artificio: un agente ossidante comunemente utilizzato nella produzione di fuochi d’artificio.
- Fiammiferi: utilizzati anche nella produzione di fiammiferi di sicurezza, poiché possono essere facilmente accesi.
- Erbicidi: Utilizzato come erbicida perché può uccidere selettivamente alcune erbe infestanti senza danneggiare i raccolti.
- Agente ossidante: utilizzato come agente ossidante nella produzione di altri prodotti chimici, come perclorati e clorati.
- Prodotti farmaceutici: utilizzati anche nella produzione di prodotti farmaceutici, come i farmaci antinfettivi.
- Reagente da laboratorio: utilizzato come reagente da laboratorio per la chimica analitica.
- Produzione di pigmenti: utilizzato nella produzione di pigmenti, come il blu oltremare.
Domande:
D: Qual è la formula del clorato di calcio?
R: La formula chimica del clorato di calcio è Ca(ClO3)2.
D: A cosa serve il clorato di calcio?
R: Ca(ClO3)2 ha varie applicazioni industriali, come agente sbiancante nell’industria della pasta di legno e della carta, agente ossidante nella produzione di altri prodotti chimici, erbicidi, pigmenti di produzione e reagenti di laboratorio.
D: Il clorato di calcio è un solido?
R: Sì, Ca(ClO3)2 è un solido a temperatura ambiente.
D: Dove si trova più comunemente il clorato di sodio e a cosa serve il clorato di calcio?
R: Il clorato di sodio si trova più comunemente nell’industria chimica, dove viene utilizzato come agente ossidante ed erbicida. Il Ca(ClO3)2, invece, viene utilizzato come agente sbiancante, agente ossidante ed erbicida in vari settori.
D: Qual è il numero totale di atomi nel composto Ca(ClO3)2?
R: Il composto Ca(ClO3)2 ha un totale di 13 atomi: 1 atomo di calcio, 2 atomi di cloro e 6 atomi di ossigeno dai due ioni ClO3-.
D: Qual è la percentuale in massa di cloro in Ca(ClO3)2?
R: La massa atomica del cloro è 35,5 g/mol e la massa molare di Ca(ClO3)2 è 238,98 g/mol. Pertanto, la percentuale in massa di cloro in Ca(ClO3)2 è (2 x 35,5 g/mol) / 238,98 g/mol x 100% = 29,68%.
D: Quanti atomi di cloro ci sono nel Ca(ClO3)2?
R: Ci sono due atomi di cloro in Ca(ClO3)2, rappresentati dai due gruppi ClO3.
D: Qual è la massa di ciascun composto nella miscela originale di Ca(ClO3)2 e Ca(ClO)2?
R: È impossibile determinare la massa di ciascun composto nella miscela originale senza informazioni aggiuntive, come la massa totale o il rapporto di massa tra i due composti.
