Il diclorometano (CH2Cl2) o cloruro di metilene dissolve un’ampia gamma di composti organici ed è comunemente usato come solvente nei laboratori chimici. Può essere utilizzato anche nei processi di sverniciatura e sgrassaggio.
| Nome IUPAC | Diclorometano |
| Formula molecolare | CH2Cl2 |
| numero CAS | 75-09-2 |
| Sinonimi | Cloruro di metilene, dicloruro di metilene, DCM, Narkotil, Solaesthin, Solmethine, ecc. |
| InChI | InChI=1S/CH2Cl2/c2-1-3/h1H2 |
Densità del diclorometano g/ml
La densità del diclorometano è 1,326 g/mL. Questo valore indica la massa di diclorometano per unità di volume a una data temperatura e pressione. La densità del diclorometano è relativamente elevata, rendendolo un liquido più denso dell’acqua. Questa proprietà lo rende utile in alcune applicazioni di laboratorio, dove può essere utilizzato per separare sostanze di diversa densità.
Punto di ebollizione del diclorometano
Il punto di ebollizione del diclorometano è 39,6°C (103,3°F). Questa temperatura indica il punto in cui la forma liquida del diclorometano passerà allo stato gassoso. Il basso punto di ebollizione del diclorometano lo rende un composto molto volatile che può facilmente vaporizzare a temperatura ambiente. Questa proprietà lo rende utile come solvente in molte applicazioni di laboratorio, dove può essere facilmente evaporato.
Massa molare del diclorometano
La massa molare del diclorometano, chiamato anche cloruro di metilene, è 84,93 g/mol. Questo valore si ottiene sommando le masse atomiche degli atomi di una singola molecola di diclorometano. La formula molecolare del diclorometano è CH2Cl2, che indica che contiene un atomo di carbonio, due atomi di idrogeno e due atomi di cloro. La massa molare è una proprietà importante per determinare la quantità di una sostanza presente in un dato campione.
Punto di fusione del diclorometano
Il punto di fusione di CH2Cl2 è -97,4°C (-143,3°F). Questa temperatura indica il punto in cui la forma solida di CH2Cl2 passerà allo stato liquido. Tuttavia, CH2Cl2 si trova raramente nella sua forma solida, poiché è un liquido volatile a temperatura ambiente. Il basso punto di fusione del CH2Cl2 rende difficile il congelamento e rimane liquido anche a basse temperature.
Peso molecolare del diclorometano
Il peso molecolare di CH2Cl2 è 84,93 g/mol. Questo valore è la somma dei pesi atomici degli atomi di una singola molecola CH2Cl2. Il peso molecolare è una proprietà importante per determinare la quantità di una sostanza presente in un dato campione.
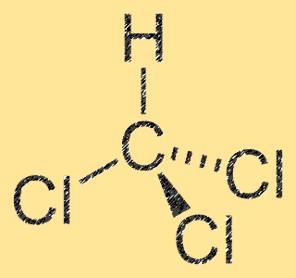
Struttura del diclorometano
CH2Cl2 ha una struttura molecolare tetraedrica, con un atomo di carbonio centrale legato a due atomi di cloro e due atomi di idrogeno. La molecola ha un momento dipolare, che risulta dalla differenza di elettronegatività tra gli atomi di carbonio e di cloro. L’atomo di carbonio ha una carica parzialmente positiva, mentre gli atomi di cloro hanno una carica parzialmente negativa. Questa proprietà rende CH2Cl2 una molecola polare.
Formula del diclorometano
La formula molecolare del diclorometano è CH2Cl2. La formula indica che la molecola contiene un atomo di carbonio, due atomi di idrogeno e due atomi di cloro. La formula fornisce anche informazioni sul numero relativo di atomi in una singola molecola di diclorometano. La formula è utile per determinare la stechiometria delle reazioni chimiche che coinvolgono il diclorometano.
| Aspetto | Liquido incolore |
| Peso specifico | 1.326 |
| Colore | Incolore |
| Odore | Odore delicato, simile al cloroformio |
| Massa molare | 84,93 g/mole |
| Densità | 1.326 g/ml |
| Punto di fusione | -97,4°C (-143,3°F) |
| Punto di ebollizione | 39,6°C (103,3°F) |
| Punto flash | -22°C (-8°F) |
| solubilità in acqua | 16,5 g/l a 20°C (68°F) |
| Solubilità | Miscibile con molti solventi organici |
| Pressione del vapore | 44,6 kPa a 20°C (68°F) |
| Densità del vapore | 2.93 |
| pKa | 4 |
| pH | Neutro |
Sicurezza e pericoli del diclorometano
Il diclorometano (CH2Cl2), noto anche come cloruro di metilene, è una sostanza chimica pericolosa che comporta notevoli rischi per la sicurezza se non gestita correttamente. È altamente infiammabile e può provocare incendi o esplosioni se esposto a calore o fiamme libere. L’inalazione dei suoi vapori può causare irritazione respiratoria, mal di testa, vertigini e persino perdita di coscienza. Il contatto della pelle con CH2Cl2 può causare irritazioni, ustioni o ustioni chimiche. È anche un potenziale cancerogeno, poiché l’esposizione a lungo termine aumenta il rischio di cancro al fegato e ai polmoni. Quando si lavora con CH2Cl2 sono essenziali adeguate precauzioni di sicurezza, come l’utilizzo di dispositivi di protezione individuale adeguati e il lavoro in un’area ben ventilata.
| Simboli di pericolo | Xn, F |
| Descrizione della sicurezza | Liquido e vapori altamente infiammabili. Nocivo se ingerito, inalato o assorbito attraverso la pelle. Provoca irritazione cutanea e grave irritazione oculare. Può causare irritazione respiratoria. Può provocare sonnolenza o vertigini. Può essere fatale se ingerito e penetra nelle vie respiratorie. |
| Identificatori AN | ONU 1593 |
| Codice SA | 29031200 |
| Classe di pericolo | 3 |
| Gruppo di imballaggio | II |
| Tossicità | Il diclorometano è classificato come cancerogeno di categoria 2 ed è stato collegato al cancro al fegato e ai polmoni. È noto anche che provoca depressione del sistema nervoso centrale e può essere fatale se ingerito o inalato in concentrazioni elevate. Quando si lavora con il diclorometano è necessario adottare sempre adeguate precauzioni di sicurezza. |
Metodi di sintesi del diclorometano
Esistono diversi metodi per sintetizzare il diclorometano (CH2Cl2), un liquido incolore utilizzato come solvente e sverniciante. Un metodo comune prevede la reazione del gas metano con il cloro gassoso in presenza di un catalizzatore, solitamente cloruro di alluminio o cloruro ferrico. La reazione produce come sottoprodotti sia CH2Cl2 che gas di acido cloridrico. Un altro metodo prevede la clorurazione del metanolo con acido cloridrico gassoso o cloruro di tionile. Questa reazione produce anche CH2Cl2 come prodotto, nonché acqua o anidride solforosa come sottoprodotti.
Un altro metodo prevede la reazione del cloroformio con lo zinco in presenza di acido cloridrico. Questa reazione produce come prodotti sia CH2Cl2 che cloruro di zinco, con idrogeno gassoso come sottoprodotto.
La clorazione di vari composti organici, come l’etano o il propano, in presenza di un catalizzatore può produrre CH2Cl2 come sottoprodotto.
Indipendentemente dal metodo utilizzato, è importante maneggiare con cura CH2Cl2 a causa delle sue proprietà pericolose. Durante la sintesi e la manipolazione di CH2Cl2, è importante adottare adeguate precauzioni di sicurezza, come indossare dispositivi di protezione individuale adeguati e lavorare in un’area ben ventilata.
Usi del diclorometano
Il diclorometano, noto anche come cloruro di metilene, trova molte applicazioni nell’industria e nella ricerca come solvente organico versatile. Svolge un ruolo cruciale nella produzione di prodotti farmaceutici e rivestimenti come pitture e vernici. Inoltre, è un detergente utile nelle industrie manifatturiere elettroniche e metallurgiche per lo sgrassaggio.
Il diclorometano dissolve e rimuove molti tipi di vernici e rivestimenti, rendendolo uno sverniciante popolare. Degno di nota è anche il suo utilizzo come agente espandente nella produzione di schiume poliuretaniche, resine di policarbonato e altre materie plastiche.
Oltre ai suoi usi industriali, il diclorometano è prezioso nell’estrazione di prodotti naturali come oli essenziali e profumi da materiali vegetali. È anche un solvente efficace per molti composti organici utilizzati nei reagenti di laboratorio nella sintesi organica.
Tuttavia, il diclorometano richiede un’attenta manipolazione a causa delle sue proprietà pericolose come infiammabilità e tossicità. È importante adottare adeguate precauzioni di sicurezza, incluso lavorare in un’area ben ventilata e indossare dispositivi di protezione individuale adeguati quando si lavora con il diclorometano.
Domande:
D: Il diclorometano è polare?
R: Sì, il diclorometano è un solvente polare.
D: Quali dei seguenti rischi sono associati al diclorometano?
R: I pericoli associati al diclorometano includono la sua infiammabilità, tossicità e potenziale irritazione della pelle e delle vie respiratorie.
D: Il diclorometano è infiammabile?
R: Sì, il diclorometano è infiammabile e può provocare incendi o esplosioni se esposto a calore o fiamme libere.
D: Il diclorometano è solubile in acqua?
R: Sì, il diclorometano è leggermente solubile in acqua. Tuttavia, viene utilizzato principalmente come solvente per composti non polari e non è comunemente utilizzato nelle soluzioni acquose.
