Il solfato di calcio (CaSO4) è una polvere bianca presente in natura o prodotta industrialmente. È utilizzato nell’edilizia, negli alimenti e in medicina grazie alle sue proprietà come legante, riempitivo e nutriente.
| Nome IUPAC | Solfato di calcio |
| Formula molecolare | CaSO4 |
| numero CAS | 7778-18-9 |
| Sinonimi | Gesso, gesso anidro, anidrite, diidrato, sale di calcio, selenite |
| InChI | InChI=1S/Ca.H2O4S/c;1-5(2,3)4/h;(H2,1,2,3,4)/q+2;/p-2 |
Proprietà del solfato di calcio
Formula del solfato di calcio
La formula chimica del solfato di calcio è CaSO4. Ciò significa che ciascuna molecola di solfato di calcio contiene un atomo di calcio, un atomo di zolfo e quattro atomi di ossigeno. La formula viene utilizzata per rappresentare la composizione del solfato di calcio nelle equazioni chimiche e per calcolare la quantità di reagenti necessari nelle reazioni chimiche.
Massa molare del solfato di calcio
La massa molare di CaSO4 è di circa 136,14 g/mol. Questo valore viene calcolato aggiungendo le masse atomiche di un atomo di calcio, un atomo di zolfo e quattro atomi di ossigeno nel composto. La massa molare viene utilizzata per determinare la quantità di CaSO4 necessaria nelle reazioni chimiche e per calcolarne la concentrazione nelle soluzioni.
Punto di ebollizione del solfato di calcio
CaSO4 non ha un punto di ebollizione definito perché subisce una decomposizione termica prima di raggiungere il punto di ebollizione. Può tuttavia essere riscaldato a temperature superiori a 200°C senza subire decomposizione. A temperature più elevate, CaSO4 subisce una decomposizione endotermica per formare ossido di calcio e triossido di zolfo.
Punto di fusione del solfato di calcio
Il punto di fusione del CaSO4 dipende dal suo stato di idratazione. La forma anidra di CaSO4 ha un punto di fusione di circa 1460°C, mentre la forma diidrata ha un punto di fusione inferiore di circa 128°C. Le forme emiidrato e triidrato hanno punti di fusione intermedi.
Densità del solfato di calcio g/mL
La densità di CaSO4 dipende dalla sua forma e dal suo stato di idratazione. La forma anidra di CaSO4 ha una densità di circa 2,96 g/mL, mentre la forma diidrata ha una densità di circa 2,32 g/mL. Le forme emiidrata e triidrata hanno densità intermedie.
Peso molecolare del solfato di calcio
Il peso molecolare di CaSO4 è di circa 136,14 g/mol. Questo valore viene calcolato aggiungendo le masse atomiche di un atomo di calcio, un atomo di zolfo e quattro atomi di ossigeno nel composto. Il peso molecolare viene utilizzato per calcolare la quantità di CaSO4 necessaria nelle reazioni chimiche e per determinarne la concentrazione nelle soluzioni.
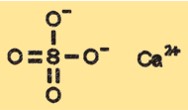
Struttura del solfato di calcio
CaSO4 ha una struttura cristallina che può variare a seconda del suo stato di idratazione. La forma anidra di CaSO4 ha una struttura cristallina classificata come ortorombica, mentre la forma diidrata ha una struttura cristallina monoclina. Le forme emiidrato e triidrato hanno strutture cristalline diverse che sono intermedie tra le forme anidra e diidrata.
| Aspetto | Polvere bianca o solida |
| Peso specifico | 2,96 (anidro), 2,32 (diidrato) |
| Colore | Bianco o incolore |
| Odore | Inodore |
| Massa molare | 136,14 g/mole |
| Densità | 2,96 g/cm³ (anidro), 2,32 g/cm³ (diidrato) |
| Punto di fusione | 1460°C (anidro), 128°C (diidrato) |
| Punto di ebollizione | Non ha un punto di ebollizione definito |
| Punto flash | Non applicabile |
| solubilità in acqua | 0,24 g/100 ml (20°C) |
| Solubilità | Solubile in acqua e glicerolo, insolubile in etanolo |
| Pressione del vapore | Trascurabile |
| Densità del vapore | Non applicabile |
| pKa | 9,8 (prima dissociazione), 11,8 (seconda dissociazione) |
| pH | 7 (neutro) |
Sicurezza e pericoli del solfato di calcio
Il CaSO4 è generalmente considerato sicuro da usare e maneggiare, ma può comportare alcuni rischi per la salute se non gestito correttamente. L’inalazione di polvere di CaSO4 può causare irritazione al sistema respiratorio, mentre l’ingestione di grandi quantità del composto può causare disturbi gastrointestinali. Il contatto degli occhi e della pelle con CaSO4 può causare irritazione o secchezza. CaSO4 può anche reagire con alcune sostanze chimiche per produrre sottoprodotti pericolosi. Pertanto, è necessario indossare dispositivi di protezione individuale adeguati durante la manipolazione di CaSO4 e conservarli in un’area fresca, asciutta e ben ventilata, lontano da materiali incompatibili.
| Simboli di pericolo | Nessuno |
| Descrizione della sicurezza | Nocivo se ingerito. Provoca irritazione alla pelle e agli occhi. |
| Numeri di identificazione delle Nazioni Unite | Non regolato |
| Codice SA | 2833.29.00 |
| Classe di pericolo | Non classificata come sostanza o miscela pericolosa secondo il Regolamento (CE) n. 1272/2008 [CLP] |
| Gruppo di imballaggio | Non applicabile |
| Tossicità | LD50 (orale, ratto): > 2000 mg/kg |
Metodi di sintesi del solfato di calcio
Diversi metodi consentono di sintetizzare CaSO4 a seconda della forma desiderata e dello stato di idratazione del composto.
Un metodo comune consiste nel far reagire il carbonato di calcio o l’ossido di calcio con acido solforico. La reazione produce rispettivamente CaSO4 e anidride carbonica o acqua.
Un altro metodo prevede la reazione del cloruro di calcio con il solfato di sodio , con conseguente precipitazione di CaSO4. La disidratazione termica del gesso, una forma minerale naturale di CaSO4 diidrato, produce CaSO4.
Alcuni processi industriali, come la desolforazione dei gas di scarico delle centrali elettriche, producono CaSO4 come sottoprodotto. Durante questo processo, l’anidride solforosa reagisce con il carbonato di calcio per formare solfito di calcio, che subisce l’ossidazione per produrre CaSO4.
Il metodo di sintesi utilizzato per CaSO4 può influenzarne le proprietà, come dimensione delle particelle, cristallinità e purezza. È quindi importante scegliere il metodo adeguato all’applicazione prevista del composto.
Usi del solfato di calcio
CaSO4 ha molti usi in diversi settori grazie alle sue proprietà uniche tra cui bassa tossicità, alto punto di fusione e colore bianco. Alcuni usi comuni di CaSO4 includono:
- Edilizia: un componente chiave del cemento e del cartongesso, dove funge da legante e mastice.
- Alimenti e bevande: utilizzato come coagulante nella produzione del tofu e come agente rassodante in alcuni formaggi e verdure in scatola.
- Prodotti farmaceutici: utilizzati come riempitivo e legante nella produzione di compresse e capsule.
- Agricoltura: utilizzato come ammendante per migliorare la struttura del suolo e aumentare la resa del raccolto.
- Prodotti chimici: utilizzati nella produzione di vari prodotti chimici, come pigmenti, carta e lavorazione tessile.
- Cosmetici: utilizzato nelle formulazioni cosmetiche come agente volumizzante e opacizzante.
- Trattamento dell’acqua: utilizzato nel trattamento dell’acqua per rimuovere le impurità e ridurre le incrostazioni.
- Plastica e gomma: utilizzato come riempitivo e agente rinforzante nei prodotti in plastica e gomma.
Domande:
D: Il solfato di calcio è vegano?
R: Sì, CaSO4 è considerato vegano perché non proviene da fonti animali.
D: Qual è stato l’uso principale del solfato di calcio negli ospedali?
R: CaSO4 era comunemente usato negli ospedali come gesso per le fratture ossee.
D: Quali masse di solfato di calcio e fosforo?
R: Questa domanda è incompleta e richiede maggiori informazioni per fornire una risposta specifica.
D: CaSO4 è solubile in acqua?
R: CaSO4 ha una bassa solubilità in acqua, con una solubilità di circa 2,05 g/L a temperatura ambiente.
D: Il CaSO4 è solubile?
R: Il solfato di calcio ha una bassa solubilità in acqua, con una solubilità di circa 2,05 g/L a temperatura ambiente.
D: Qual è la massa molare di CaSO4?
R: La massa molare di CaSO4 è circa 136,14 g/mol.
D: Quale sale ha un pH < 7? KBr, HCOOK, CaSO4, NH4NO3
R: Nessuno dei sali elencati ha un pH < 7 nella loro forma pura. Tuttavia, quando disciolto in acqua, NH4NO3 (nitrato di ammonio) produrrà una soluzione acida con un pH <7.
