Il solfito di calcio (CaSO3) è un composto che contiene ioni Ca2+ e SO32-. Viene spesso utilizzato come conservante alimentare, antiossidante e purificatore dell’acqua grazie alla sua capacità di rimuovere le impurità e prevenire il deterioramento.
| Nome IUPAC | Solfito di calcio |
| Formula molecolare | CaSO3 |
| numero CAS | 10257-55-3 |
| Sinonimi | Solfito di calcio; Acido solforoso, sale di calcio; Acido solforoso di calcio; Acido solforoso di calcio; E226 |
| InChI | InChI=1S/Ca.H2O3S/c;1-4(2)3/h;(H2,1,2,3)/q+2;/p-2 |
Proprietà del solfito di calcio
Formula di solfito di calcio
La formula chimica del solfito di calcio è CaSO3. Questo composto è composto da uno ione Ca2+ e uno ione SO32-. Il solfito di calcio può essere preparato facendo reagire l’idrossido di calcio con acido solforoso. È comunemente usato nell’industria alimentare come conservante e antiossidante, nonché come depuratore dell’acqua.
Massa molare del solfito di calcio
La massa molare di CaSO3 è 120,14 g/mol. Questo può essere calcolato aggiungendo le masse atomiche di calcio (40,08 g/mol), zolfo (32,06 g/mol) e tre atomi di ossigeno (16,00 g/mol ciascuno).
Punto di ebollizione del solfito di calcio
CaSO3 non ha un punto di ebollizione ben definito perché si decompone prima di raggiungere il punto di ebollizione. Tuttavia, può essere riscaldato fino a una temperatura di circa 450°C prima che avvenga la decomposizione. Questo perché CaSO3 è un composto instabile e tende a decomporsi in solfato di calcio e anidride solforosa quando riscaldato.
Punto di fusione del solfito di calcio
Il punto di fusione di CaSO3 è di circa 1520°C. Questa è la temperatura alla quale il composto solido passa allo stato liquido. CaSO3 ha una struttura cristallina e fonde ad alte temperature a causa dei forti legami ionici tra ioni calcio e solfito.
Densità del solfito di calcio g/mL
La densità di CaSO3 è di circa 2,71 g/mL. Ciò significa che un millilitro di CaSO3 ha una massa di 2,71 grammi. L’elevata densità di CaSO3 è dovuta alla presenza dello ione calcio, che ha un’elevata massa atomica.
Peso molecolare del solfito di calcio
Il peso molecolare di CaSO3 è 120,14 g/mol. Questo può essere calcolato aggiungendo i pesi atomici di calcio, zolfo e tre atomi di ossigeno nel composto. Il peso molecolare di CaSO3 è importante per determinarne le proprietà fisiche e chimiche.
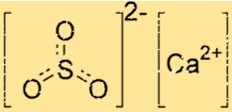
Struttura del solfito di calcio
La struttura di CaSO3 è costituita da uno ione Ca2+ e uno ione SO32-. Lo ione calcio è circondato da sei atomi di ossigeno, mentre lo ione solfito ha due atomi di ossigeno e un atomo di zolfo. Lo ione Ca2+ e lo ione SO32- sono tenuti insieme da legami ionici, che sono forti forze elettrostatiche di attrazione tra ioni con carica opposta.
Solubilità del solfito di calcio
CaSO3 è scarsamente solubile in acqua, con una solubilità di circa 0,17 g/100 ml a temperatura ambiente. Ciò significa che solo una piccola quantità di CaSO3 può dissolversi nell’acqua e le restanti particelle solide rimarranno sospese nell’acqua. La solubilità di CaSO3 è influenzata da fattori quali temperatura, pH e presenza di altri ioni.
| Aspetto | Polvere bianca o solido cristallino |
| Peso specifico | 2.71 |
| Colore | Bianco |
| Odore | Inodore |
| Massa molare | 120,14 g/mole |
| Densità | 2,71 g/ml |
| Punto di fusione | 1520°C |
| Punto di ebollizione | Si decompone prima di raggiungere il punto di ebollizione |
| Punto flash | Non applicabile |
| solubilità in acqua | Leggermente solubile, ca. 0,17 g/100 ml a temperatura ambiente. |
| Solubilità | Insolubile in alcool ed etere |
| Pressione del vapore | Non applicabile |
| Densità del vapore | Non applicabile |
| pKa | 1.91 |
| pH | Leggermente basico (pH 8-9 se disciolto in acqua) |
Sicurezza e pericoli del solfito di calcio
CaSO3 è generalmente considerato sicuro per l’uso nelle applicazioni di trattamento degli alimenti e dell’acqua. Tuttavia, come qualsiasi sostanza chimica, può comportare alcuni pericoli se non maneggiata correttamente. CaSO3 è irritante per la pelle e gli occhi e può causare irritazione alle vie respiratorie se inalato. L’ingestione di grandi quantità di CaSO3 può causare nausea, vomito e diarrea. Quando si maneggia CaSO3, è necessario adottare adeguate precauzioni di sicurezza, come indossare guanti e occhiali protettivi. Si dovrebbe consultare immediatamente un medico se si entra in contatto con CaSO3 sulla pelle, sugli occhi o se lo si ingerisce. È inoltre importante seguire le corrette procedure di conservazione e smaltimento del CaSO3 per ridurre al minimo i potenziali rischi.
| Simboli di pericolo | Nessuno assegnato |
| Descrizione della sicurezza | Evitare il contatto con gli occhi, la pelle e gli indumenti. Indossare guanti e occhiali protettivi durante la manipolazione. In caso di contatto, sciacquare le zone interessate con acqua. In caso di ingestione, consultare immediatamente un medico. |
| Numeri di identificazione delle Nazioni Unite | Non applicabile |
| Codice SA | 283210 |
| Classe di pericolo | Non classificato come pericoloso |
| Gruppo di imballaggio | Non applicabile |
| Tossicità | Il solfito di calcio è considerato non tossico a basse concentrazioni, ma può causare irritazione gastrointestinale e altri effetti sulla salute a dosi elevate. |
Metodi di sintesi del solfito di calcio
La reazione dell’acido solforoso con l’idrossido di calcio può sintetizzare CaSO3. La reazione produce CaSO3 e acqua come sottoprodotti.
Un altro metodo prevede la reazione del carbonato di calcio con l’acido solforoso, che produce CaSO3, acqua e anidride carbonica. Tipicamente, i chimici effettuano la reazione in una soluzione acquosa a temperatura ambiente o leggermente superiore.
In un altro metodo, la reazione dell’ossido di calcio con l’anidride solforosa e quindi l’aggiunta di acqua al prodotto risultante produce CaSO3.
In ambienti industriali, l’assorbimento dell’anidride solforosa in una sospensione di idrossido di calcio generalmente produce CaSO3. Questo processo produce una miscela di CaSO3 e solfato di calcio, che può essere separata mediante filtrazione o altri metodi. Il CaSO3 risultante può essere utilizzato in una varietà di applicazioni, compreso il trattamento dell’acqua e come conservante alimentare.
Nel complesso, esistono diversi metodi per sintetizzare CaSO3, ciascuno con i propri vantaggi e limiti a seconda dell’applicazione specifica e della purezza desiderata del prodotto finale.
Usi del solfito di calcio
CaSO3 ha vari usi in diversi settori grazie alle sue proprietà uniche. Alcuni usi comuni di CaSO3 includono:
- Trattamento dell’acqua: spesso utilizzato come agente di trattamento dell’acqua per rimuovere le impurità e disinfettare l’acqua. Può rimuovere efficacemente cloro, metalli pesanti e altri contaminanti dall’acqua.
- Conservazione degli alimenti: utilizzato come conservante alimentare per prevenire il deterioramento e prolungare la durata di conservazione dei prodotti alimentari. Comunemente utilizzato nella produzione di alimenti in scatola e in bottiglia, nonché nella produzione di vino e birra.
- Industria chimica: utilizzato nell’industria chimica come agente riducente e nella produzione di acido solforico.
- Edilizia: utilizzato come componente di materiali da costruzione come cartongesso e cemento.
- Industria agricola: utilizzato in agricoltura per trattare il suolo e prevenire le malattie delle piante.
- Applicazioni mediche: utilizzato anche in applicazioni mediche come antiossidante e come trattamento per determinate condizioni mediche.
Domande:
D: Qual è la formula del solfito di calcio?
R: La formula del solfito di calcio è CaSO3.
D: Qual è la condizione del solfito di calcio?
R: CaSO3 è un solido a temperatura ambiente.
D: Quanti grammi di calcio ci sono in 3,36 grammi di CaSO3?
R: In 3,36 grammi di CaSO3 sono presenti circa 1,14 grammi di calcio.
D: Cosa succede quando si aggiunge carbonato di calcio all’acido cloridrico e al solfito di sodio?
R: Quando il carbonato di calcio viene aggiunto all’acido cloridrico e al solfito di sodio, si verifica una reazione che produce CaSO3, acqua, anidride carbonica e cloruro di sodio.
D: Il solfito di calcio si dissolve in acqua?
R: Sì, CaSO3 è leggermente solubile in acqua.
D: C’è solfito di calcio nell’acqua della città?
R: CaSO3 non si trova comunemente nell’acqua cittadina, ma può essere utilizzato nei processi di trattamento dell’acqua per rimuovere le impurità.
D: Il CaSO3 può essere rimosso dall’acqua potabile?
R: Sì, il CaSO3 può essere rimosso dall’acqua potabile con vari metodi come filtrazione, osmosi inversa o trattamento chimico.
D: Cosa producono CaSO3 e HCl?
R: Quando CaSO3 viene aggiunto all’acido cloridrico, si verifica una reazione che produce cloruro di calcio, anidride solforosa e acqua.
