Il carburo di calcio è un composto chimico con la formula CaC2. Viene utilizzato principalmente per produrre gas acetilene e calciocianammide. Reagisce con l’acqua per produrre gas acetilene e idrossido di calcio. Le persone lo usano per la saldatura e l’illuminazione.
| Nome dell’IUPAC | Etinidiide di calcio |
| Formula molecolare | CaC2 |
| numero CAS | 75-20-7 |
| Sinonimi | Acetiluro di calcio, percarbonio di calcio, dicarburo di calcio, carburo di calcio, carburo calcico, etinidiide di calcio |
| InChI | InChI=1S/C2.Ca/c1-2;/q-2;+2 |
Proprietà del carburo di calcio
Formula del carburo di calcio
La formula chimica del carburo di calcio è CaC2. Ciò significa che una molecola di carburo di calcio è costituita da un atomo di calcio e due atomi di carbonio. La formula mostra il rapporto tra gli elementi del composto.
Massa molare del carburo di calcio
La massa molare di CaC2 è 64,099 g/mol. Ciò significa che una mole di CaC2 ha una massa di 64.099 grammi. La massa molare si calcola sommando le masse atomiche degli elementi nella formula. La massa atomica del calcio è 40,078 g/mol e quella del carbonio è 12,011 g/mol.
Punto di ebollizione del carburo di calcio
Il punto di ebollizione del CaC2 è 2300°C. Ciò significa che CaC2 cambia da liquido a gas a questa temperatura. Il punto di ebollizione è influenzato dalle forze intermolecolari e dalla pressione atmosferica. CaC2 ha forti legami ionici che richiedono molta energia per rompersi.
Punto di fusione del carburo di calcio
Il punto di fusione del CaC2 è 2160°C. Ciò significa che CaC2 cambia da solido a liquido a questa temperatura. Il punto di fusione è influenzato anche dalle forze intermolecolari e dalla pressione atmosferica. CaC2 ha un punto di fusione elevato grazie ai suoi forti legami ionici.
Densità del carburo di calcio g/ml
La densità di CaC2 è 2,22 g/ml. Ciò significa che un millilitro di CaC2 ha una massa di 2,22 grammi. La densità si calcola dividendo la massa per il volume. La densità dipende dalla configurazione e dalla disposizione degli atomi o delle molecole nella sostanza. CaC2 ha un’alta densità perché i suoi atomi sono strettamente raggruppati in una struttura cristallina.
Peso molecolare del carburo di calcio
Il peso molecolare di CaC2 è 64.099 amu (unità di massa atomica). Ciò significa che una molecola di CaC2 ha una massa di 64.099 amu. Il peso molecolare si calcola moltiplicando le masse atomiche degli elementi nella formula per il rispettivo numero di atomi. La massa atomica del calcio è 40.078 amu e quella del carbonio è 12.011 amu.
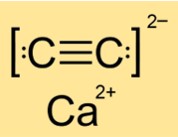
Struttura del carburo di calcio
La struttura del CaC2 è tetragonale, monoclina o monoclina a seconda della fase (I, II o III). Ciò significa che CaC2 ha forme e disposizioni diverse dei suoi atomi o molecole in diversi stati o condizioni. La struttura è determinata dalla simmetria e dalla geometria della sostanza. CaC2 ha una struttura tetragonale nella fase I, una struttura monoclina nella fase II e un’altra struttura monoclina nella fase III.
Solubilità del carburo di calcio
La solubilità di CaC2 è una rapida idrolisi in acqua. Ciò significa che CaC2 reagisce rapidamente con l’acqua e forma come prodotti gas acetilene e idrossido di calcio. La solubilità è misurata dalla quantità di sostanza che può dissolversi in un dato solvente a una data temperatura e pressione. La solubilità dipende dalla natura e dalla polarità della sostanza e del solvente, nonché da altri fattori come il pH e la salinità.
| Aspetto | Polvere bianca con cristalli grigio/neri o solido cristallino incolore 3 |
| Densità specifica | 2.22 |
| Colore | Incolore (puro) o grigio/marrone (qualità tecnica) |
| Odore | Inodore (puro) o simile all’aglio (grado tecnico) |
| Massa molare | 64.099 g/mole |
| Densità | 2,22 g/cm3 |
| Punto di fusione | 2160°C |
| Punto di ebollizione | 2300°C |
| Punto flash | 305°C (acetilene) |
| solubilità in acqua | Idrolisi rapida |
| Solubilità | Insolubile in etanolo ed etere |
| Pressione del vapore | Trascurabile |
| Densità del vapore | 2.21 (acetilene) |
| pKa | Non applicabile |
| pH | Non applicabile |
Sicurezza e pericoli del carburo di calcio
CaC2 è una sostanza chimica infiammabile e pericolosa. Potrebbe causare pericolo di incendio ed esplosione quando entra in contatto con acqua o umidità. Rilascia gas acetilene, anch’esso infiammabile ed esplosivo. Il CaC2 può anche nuocere alla salute. Questo può irritare la pelle, gli occhi e i polmoni. Ciò può causare eruzioni cutanee, danni agli occhi, tosse e mancanza di respiro. Può anche causare l’accumulo di liquido nei polmoni se ne inali una grande quantità. Dovresti evitare il contatto con CaC2 e indossare dispositivi di protezione durante la manipolazione. Dovresti anche conservarlo in un contenitore asciutto e chiuso, lontano da qualsiasi fonte di accensione.
| Simboli di pericolo | F (altamente infiammabile), C (corrosivo), W (reagisce con l’acqua) |
| Descrizione della sicurezza | S2 (tenere fuori dalla portata dei bambini), S7/8 (tenere il contenitore ben chiuso e asciutto), S16 (tenere lontano da fonti di accensione), S26 (in caso di contatto con gli occhi, lavare immediatamente e abbondantemente con acqua e consultare un medico consiglio), S36/37/39 (indossare indumenti protettivi, guanti adatti e proteggersi gli occhi/il viso), S43 (in caso di incendio, usare sabbia asciutta o polvere chimica secca), S45 (in caso di incidente o disagio, chiedere consiglio medico immediato) |
| Numeri di identificazione delle Nazioni Unite | ONU 1402 |
| Codice SA | 28491000 |
| Classe di pericolo | 4.3 |
| Gruppo di imballaggio | IO |
| Tossicità | LD50 orale ratto: 80 mg/kg, LC50 inalazione ratto: 1000 ppm/4h |
Metodi di sintesi del carburo di calcio
Esistono diversi metodi per sintetizzare CaC2 da fonti di calcio e ossido di carbonio.
Uno dei metodi più comuni è il metodo del forno ad arco elettrico. In questo processo, un arco elettrico riscalda una miscela di calce e coke a circa 2.200°C. La reazione è endotermica e produce CaC2 fuso e monossido di carbonio. Dopo la fusione, il CaC2 si raffredda e le persone lo macinano in pezzi o polvere, a seconda dell’uso previsto. Questo metodo comporta un elevato consumo di energia e costi di attrezzatura.
Un altro metodo è il metodo allo stato solido. Per eseguire questo metodo, riscaldare una miscela di ossido di calcio e biochar o carbone derivato da biomassa in un forno a circa 1.750°C. La reazione è solido-solido e produce CaC2 solido e monossido di carbonio. È possibile utilizzare direttamente o elaborare ulteriormente il solido CaC2. Questo metodo ha un consumo energetico e un costo delle attrezzature inferiori rispetto al metodo del forno ad arco elettrico.
Un terzo metodo è il metodo di sostituzione della qualità dell’energia con coke di carbone. Per realizzare il processo si mescolano carbone di bassa qualità e calce , si formano dei pellet, che poi vengono pirolizzati in un forno a 1000°C. Il gas prodotto genera elettricità e i pellet caldi vengono trasferiti in un forno CaC2 a 2000°C. La reazione è solido-solido e produce CaC2 fuso e monossido di carbonio. Dopo il raffreddamento, il CaC2 fuso viene macinato per formare grumi o polvere. Questo metodo ha un’efficienza energetica e un utilizzo delle risorse più elevati rispetto al metodo del forno ad arco elettrico.
Usi del carburo di calcio
- Quando CaC2 reagisce con l’acqua, produce gas acetilene e idrossido di calcio. Il gas acetilene è un importante intermedio per la sintesi di molti prodotti chimici organici e polimeri, come cloruro di polivinile, acetato di vinile, 1,4-butandiolo, ecc. L’idrossido di calcio è un composto versatile dai molteplici usi.
- Per produrre calciocianammide, gli esseri umani reagiscono CaC2 con azoto ad alte temperature. La calciocianammide agisce come fertilizzante azotato, erbicida e defoliante.
- Per ridurre il contenuto di zolfo di ferro, ghisa, ghisa e acciaio, viene utilizzato CaC2. Questo composto chimico reagisce con lo zolfo per formare solfuro di calcio, desolforando efficacemente il metallo. Questo processo migliora la qualità e la duttilità dei prodotti in acciaio.
- Le lampade a carburo utilizzano CaC2 per produrre gas acetilene che, quando bruciato, genera luce. Queste lampade erano popolari nell’industria mineraria, speleologica, ciclistica e automobilistica prima che le lampade elettriche diventassero comuni.
- Le persone usano CaC2 come agente di maturazione in frutta come banane, mango e papaia. Rilascia gas etilene, che accelera il processo di maturazione ed esalta il colore e la dolcezza del frutto. Molti paesi considerano illegale e dannosa la pratica di utilizzare residui di CaC2 per maturare i frutti a causa dei rischi per la salute ad essi associati.
- Le persone usano CaC2 nei cannoni di bambù e nei cannoni big bang per produrre rumori forti. Se mescolato con acqua produce gas acetilene che si accende per creare un’esperienza divertente e festosa per tutti.
- Utilizzato anche come disossidante nella produzione dell’acciaio. Rimuove l’ossigeno dall’acciaio fuso e previene la formazione di ossidi che possono compromettere la qualità dei prodotti siderurgici.
Domande:
D: Dove acquistare localmente il carburo di calcio?
R: Potresti riuscire a trovare piccole quantità di CaC2 nella tua zona in alcuni negozi di ferramenta o di forniture per saldatura. Tuttavia, se hai bisogno di grandi quantità di CaC2, potrebbe essere meglio importarlo direttamente dai produttori. Puoi contattare alcuni fornitori online.
D: Come rimuovere il carburo di calcio?
R: Il CaC2 è un rifiuto pericoloso e deve essere smaltito correttamente. Non dovresti gettarlo nella spazzatura o nello scarico, poiché può reagire con l’acqua e produrre gas acetilene, che è infiammabile ed esplosivo. È necessario contattare l’autorità locale per i rifiuti pericolosi o un’azienda autorizzata allo smaltimento dei rifiuti per consigli su come smaltire in modo sicuro il CaC2. Potrebbe essere necessario neutralizzarlo con acqua in un’area ben ventilata e quindi imballarlo in un contenitore sigillato per il trasporto.
D: Cosa si forma quando il carburo di calcio reagisce con l’acqua pesante?
R: L’acqua pesante è acqua che contiene deuterio invece di idrogeno. Il deuterio è un isotopo dell’idrogeno che ha un protone e un neutrone nel nucleo. Quando CaC2 reagisce con l’acqua pesante, forma idrossido di calcio e acetilene deuterato. L’acetilene deuterato è l’acetilene che contiene deuterio invece di idrogeno. L’equazione chimica per questa reazione è:
CaC2 + 2D2O -> Ca(OD)2 + C2D2
D: Il carburo di calcio è pericoloso?
R: Sì, il CaC2 è pericoloso e deve essere maneggiato con cura. Può causare pericolo di incendio ed esplosione quando entra in contatto con acqua o umidità, poiché rilascia gas acetilene, anch’esso infiammabile ed esplosivo. Può anche nuocere alla salute perché può irritare la pelle, gli occhi e i polmoni. Il CaC2 può causare eruzioni cutanee, danni agli occhi, tosse e mancanza di respiro. Può anche causare l’accumulo di liquido nei polmoni se ne inali una grande quantità. Dovresti evitare il contatto con CaC2 e indossare dispositivi di protezione durante la manipolazione. Dovresti anche conservarlo in un contenitore asciutto e chiuso, lontano da qualsiasi fonte di accensione.
D: Il carburo di calcio è ionico o covalente?
R: CaC2 è un composto ionico. È costituito da ioni calcio (Ca2+) e ioni carburo (C22-). I composti ionici si formano quando gli atomi metallici perdono elettroni e gli atomi non metallici acquistano elettroni per ottenere configurazioni elettroniche stabili. Gli ioni risultanti sono tenuti insieme da forze di attrazione elettrostatiche. CaC2 ha forti legami ionici che richiedono molta energia per rompersi.
D: Come viene prodotto il carburo di calcio?
R: Il CaC2 si ottiene riscaldando una miscela di calce (ossido di calcio) e coke (carbonio) a circa 2200°C in un forno elettrico ad arco. La reazione è endotermica e produce CaC2 fuso e monossido di carbonio. Il CaC2 fuso viene quindi raffreddato e macinato in pezzi o polvere. Questo metodo comporta un elevato consumo di energia e costi di attrezzatura. Esistono anche altri metodi che utilizzano diverse fonti di carbonio, come il biochar o il carbone di basso rango, e diversi metodi di riscaldamento, come il riscaldamento allo stato solido o il riscaldamento a induzione. Questi metodi possono avere un consumo energetico e un costo delle apparecchiature inferiori rispetto al metodo del forno ad arco elettrico.
D: Posso trasformare il carbonato di calcio in carburo di calcio?
R: No, non è possibile trasformare direttamente il carbonato di calcio in CaC2. Il carbonato di calcio è un composto stabile che non reagisce con il carbonio alle alte temperature. Il carbonato di calcio deve prima essere convertito in ossido di calcio riscaldandolo fortemente in assenza di aria (calcinazione). Quindi è possibile far reagire l’ossido di calcio con il carbonio ad alte temperature per produrre CaC2 (carburazione). L’equazione chimica complessiva per questo processo è:
CaCO3 -> CaO + CO2
CaO+3C -> CaC2+CO
D: Cosa è vero per la seguente reazione? Ca(s) + 2C(s) -> CaC2(s) + 62,8 kJ
R: Per la reazione sono vere le seguenti affermazioni:
- È una reazione sintetica in cui due o più elementi si combinano per formare un composto.
- Questa è una reazione esotermica, in cui il calore viene rilasciato nell’ambiente.
- Questa è una reazione redox, in cui il calcio viene ossidato e il carbonio viene ridotto.
- Questa è la reazione inversa della formazione di CaC2 da ossido di calcio e carbonio.
D: Qual è il calore standard di formazione di cac2(s)?
R: Il calore di formazione standard di cac2(s) è la variazione di entalpia quando una mole di CaC2 si forma dai suoi elementi nei loro stati standard a 25°C e 1 atm. Può essere calcolato dalle equazioni termochimiche fornite utilizzando la legge di Hess. L’equazione generale per la formazione di CaC2 è:
Ca(s) + 2C(s) -> CaC2(s)
Usando la legge di Hess possiamo scrivere:
ΔHf°(CaC2) = ΔH°(Ca + 2C -> CaC2)
= ΔH°(Ca + 2H2O -> Ca(OH)2 + H2) + ΔH°(Ca(OH)2 -> CaO + H2O) + ΔH°(CaO + 3C -> CaC2 + CO) + ΔH°(CO -> C + O2) + ΔH°(H2 + O2 -> H2O)
= -414,79 kJ + 65,19 kJ + 462,30 kJ – 221,00 kJ – 571,80 kJ = -680,10 kJ
Pertanto, il calore standard di formazione di cac2(s) è -680,10 kJ/mol.
D: Quanti grammi di cac2 sarebbero necessari per generare 0,35 moli di hcch(g)?
R: Per rispondere a questa domanda dobbiamo utilizzare l’equazione bilanciata per la reazione tra CaC2 e acqua:
CaC2(s) + 2H2O(l) -> C2H2(g) + Ca(OH)2(aq)
Da questa equazione possiamo vedere che una mole di cac2 produce una mole di hcch (chiamato anche acetilene). Pertanto, per generare 0,35 moli di hcch, abbiamo bisogno di 0,35 moli di cac2. Per convertire le moli in grammi dobbiamo utilizzare la massa molare di cac2, che è 64,099 g/mol. Moltiplicando le moli per la massa molare otteniamo:
0,35 moli x 64,099 g/mol = 22,435 g
Pertanto occorrono 22,435 grammi di cac2 per generare 0,35 moli di hcch.
D: Quante moli di cac2 sono necessarie per reagire completamente con 49,0 g di acqua?
R: Per rispondere a questa domanda, dobbiamo utilizzare l’equazione bilanciata per la reazione tra carburo di calcio e acqua:
CaC2(s) + 2H2O(l) -> C2H2(g) + Ca(OH)2(aq)
Da questa equazione possiamo vedere che una mole di cac2 reagisce con due moli di h2o. Pertanto, per trovare le moli di cac2 necessarie, dobbiamo dividere le moli di h2o per due. Per convertire da grammi a moli dobbiamo utilizzare la massa molare dell’acqua, che è 18,015 g/mol. Dividendo i grammi per la massa molare otteniamo:
49,0 g / 18,015 g/mol = 2,72 moli
Dividendo questo per due si ottiene:
2,72 moli/2 = 1,36 moli
Pertanto occorrono 1,36 moli di cac2 per reagire completamente con 49,0 g di h2o.
D: Quali sono i prodotti della reazione tra carburo di calcio e acqua?
R: I prodotti della reazione tra CaC2 e acqua sono gas acetilene e soluzione di idrossido di calcio.
