Il carbonato di zinco (ZnCO3) è un solido bianco, inodore formato dalla reazione dello zinco con gli ioni carbonato. Viene utilizzato in varie applicazioni, come ceramica e prodotti farmaceutici, grazie alle sue proprietà uniche.
| Nome IUPAC | Carbonato di zinco |
| Formula molecolare | ZnCO3 |
| numero CAS | 3486-35-9 |
| Sinonimi | Carbonato di zinco (II); Smithsonite; Zinco carbonato; Carbonato di zinco |
| InChI | InChI=1S/CH2O3.Zn/c2-1(3)4;/h(H2,2,3,4);/q;+2/p-2 |
Proprietà del carbonato di zinco
Formula di carbonato di zinco
La formula chimica del carbonato di zinco è ZnCO3. È costituito da un atomo di zinco (Zn), un atomo di carbonio (C) e tre atomi di ossigeno (O). Questo composto è un solido bianco, inodore e si trova comunemente in natura come minerale smithsonite.
Massa molare del carbonato di zinco
La massa molare del carbonato di zinco può essere calcolata sommando le masse atomiche dei suoi elementi costitutivi. Lo zinco ha una massa molare di circa 65,38 g/mol, il carbonio 12,01 g/mol e l’ossigeno 16,00 g/mol (circa). Pertanto, la massa molare del carbonato di zinco è di circa 125,38 g/mol.
Punto di ebollizione del carbonato di zinco
Il carbonato di zinco non ha un punto di ebollizione distinto perché si decompone quando riscaldato, rilasciando anidride carbonica e lasciando dietro di sé ossido di zinco (ZnO). È comunque stabile fino a temperature intorno ai 300°C.
Punto di fusione del carbonato di zinco
Il punto di fusione del carbonato di zinco è intorno ai 333°C (circa). A questa temperatura i carbonati di zinco subiscono una decomposizione termica e formano ossido di zinco e anidride carbonica.
Densità del carbonato di zinco g/mL
La densità del carbonato di zinco è di circa 4,398 g/mL (circa). Questo valore indica che il carbonato di zinco è un solido relativamente denso rispetto a molti altri composti.
Peso molecolare del carbonato di zinco
Il peso molecolare del carbonato di zinco, chiamato anche massa molare, è di circa 125,38 g/mol. È la massa di una mole di molecole di carbonato di zinco e viene utilizzata in vari calcoli chimici.
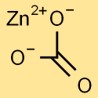
Struttura del carbonato di zinco
Il carbonato di zinco ha una struttura cristallina trigonale. Il catione zinco (Zn2+) è circondato da anioni carbonato (CO32-) in una disposizione planare trigonale. Questa disposizione conferisce al carbonato di zinco le sue proprietà fisiche e chimiche uniche.
Solubilità del carbonato di zinco
Il carbonato di zinco è scarsamente solubile in acqua. La sua solubilità diminuisce con la diminuzione della temperatura e l’aumento del pH. Può anche dissolversi in soluzioni acide a causa della formazione di sali di zinco solubili. Tuttavia, forma precipitati insolubili in presenza di carbonati o idrossidi.
| Aspetto | Solido bianco |
| Peso specifico | 4.398 g/ml (circa) |
| Colore | Bianco |
| Odore | Inodore |
| Massa molare | 125,38 g/mole |
| Densità | 4.398 g/ml (circa) |
| Punto di fusione | 333°C (circa) |
| Punto di ebollizione | Decomposto |
| Punto flash | Non applicabile |
| solubilità in acqua | Scarsamente solubile |
| Solubilità | Insolubile nella maggior parte dei solventi, può dissolversi anche in soluzioni acide |
| Pressione del vapore | Non disponibile |
| Densità del vapore | Non disponibile |
| pKa | Non disponibile |
| pH | Leggermente alcalino (circa 8-9) |
Sicurezza e pericoli del carbonato di zinco
Il carbonato di zinco presenta alcuni rischi per la sicurezza che richiedono particolare attenzione. Può irritare la pelle, gli occhi e il sistema respiratorio per contatto o inalazione. Evitare l’ingestione poiché ciò potrebbe causare disturbi gastrointestinali. Durante la manipolazione indossare adeguati dispositivi di protezione individuale, come guanti e occhiali, per evitare il contatto diretto. Conservare il carbonato di zinco in un luogo fresco e asciutto, lontano da sostanze incompatibili. In caso di ingestione o esposizione accidentale consultare immediatamente un medico. Inoltre, seguire le corrette procedure di smaltimento dei rifiuti per questo composto per ridurre al minimo l’impatto ambientale. Le corrette pratiche di manipolazione e stoccaggio sono essenziali per garantire un uso sicuro del carbonato di zinco in varie applicazioni.
| Simboli di pericolo | Nessuno |
| Descrizione della sicurezza | Nocivo se ingerito o inalato. Irritante per la pelle e gli occhi. Evita il contatto. Utilizzare con ventilazione adeguata. |
| Numeri di identificazione delle Nazioni Unite | Non applicabile |
| Codice SA | 28369900 |
| Classe di pericolo | Non classificato |
| Gruppo di imballaggio | Non applicabile |
| Tossicità | Tossicità da bassa a moderata |
Metodi di sintesi del carbonato di zinco
Il carbonato di zinco può essere sintetizzato con vari metodi. Un approccio comune consiste nel far reagire l’ossido di zinco (ZnO) con l’anidride carbonica (CO2) in presenza di acqua o di un solvente adatto. La reazione può essere condotta a temperatura e pressione controllate per favorire la formazione di carbonato di zinco.
Un altro metodo prevede la reazione del cloruro di zinco (ZnCl2) o del solfato di zinco (ZnSO4) con carbonato di sodio (Na2CO3) o carbonato di potassio (K2CO3) in una soluzione acquosa. Questo processo forma carbonato di zinco come precipitato, che può essere separato e raccolto.
Inoltre, il carbonato di zinco può essere ottenuto mediante carbonatazione dell’idrossido di zinco (Zn(OH)2) o dell’ossido di zinco con anidride carbonica, sia in forma gassosa che disciolta in acqua.
Negli ambienti industriali, il carbonato di zinco viene spesso prodotto come sottoprodotto della lavorazione dello zinco o come risultato di reazioni che coinvolgono materiali contenenti zinco.
È essenziale garantire la giusta stechiometria e condizioni di reazione durante la sintesi per ottenere un prodotto puro e di alta qualità. La scelta del metodo dipende da fattori quali la disponibilità di reagenti, la purezza desiderata del prodotto e l’applicazione prevista del carbonato di zinco.
Usi del carbonato di zinco
Il carbonato di zinco trova varie applicazioni in vari settori grazie alle sue proprietà uniche. Ecco alcuni usi notevoli:
- Ceramica: il carbonato di zinco abbassa attivamente il punto di fusione dei materiali e ne migliora la lucentezza e la trasparenza se utilizzato come fondente negli smalti ceramici.
- Prodotti farmaceutici: nelle applicazioni medicinali, il carbonato di zinco funge da ingrediente attivo in alcune formulazioni antisettiche e astringenti.
- Vernici: il carbonato di zinco funziona attivamente come pigmento bianco nelle vernici e nei rivestimenti, fornendo brillantezza e eccellente potere coprente.
- Industria della gomma: nel processo di vulcanizzazione, il carbonato di zinco agisce come un acceleratore, migliorando attivamente le proprietà meccaniche dei prodotti in gomma.
- Industria tessile: Come mordente, il carbonato di zinco migliora attivamente la ritenzione dei coloranti sui tessuti durante il processo di tintura.
- Elettronica: il carbonato di zinco trova attiva applicazione nei componenti elettronici e come materiale di rivestimento per semiconduttori, grazie alle sue proprietà elettriche.
- Agricoltura: il carbonato di zinco funziona attivamente come fungicida e preventivo contro la muffa per le colture.
- Produzione del vetro: nel processo di produzione del vetro, il carbonato di zinco agisce come agente fondente, abbassando attivamente il punto di fusione del vetro e migliorandone la trasparenza.
- Additivo per mangimi animali: i produttori aggiungono attivamente carbonato di zinco ai mangimi animali come fonte cruciale di zinco essenziale, che supporta attivamente la salute generale del bestiame.
- Trattamento dell’acqua: gli impianti di trattamento dell’acqua utilizzano attivamente il carbonato di zinco nei loro processi per controllare attivamente i livelli di pH e rimuovere attivamente le impurità dei metalli pesanti.
La versatilità del carbonato di zinco in vari settori evidenzia la sua importanza come composto prezioso con un’ampia gamma di applicazioni pratiche.
Domande:
D: ZnCO3 è solubile in acqua?
R: Il carbonato di zinco è scarsamente solubile in acqua.
D: Quale reazione è più probabile che si verifichi? Pt + FeCl3 Mn + CaO Li + ZnCO3 Cu + 2KNO3
R: La reazione più probabile è Li + ZnCO3.
D: Quale massa di ZnCO3 contiene 3,11×10^22 atomi di O?
R: La massa di ZnCO3 contenente 3,11×10^22 atomi di O può essere calcolata in base alla massa molare e alla stechiometria del composto.
D: Qual è il nome di ZnCO3?
R: Il nome di ZnCO3 è carbonato di zinco.
D: Quale dei seguenti composti è solubile in acqua? Cu3(PO4)2, CoS, Pb(NO3)2, ZnCO3?
R: ZnCO3 è scarsamente solubile in acqua.
D: Che tipo di legame si forma tra ZnCO3?
R: I legami ionici si formano tra ZnCO3.
D: Il carbonato di zinco è solubile in acqua?
R: Il carbonato di zinco è scarsamente solubile in acqua.
D: Cos’è una batteria zinco-carbone?
R: Una batteria zinco-carbone è un tipo di batteria a secco che utilizza un anodo di zinco e un catodo di carbonio con una pasta elettrolitica.
D: In cosa differisce una batteria alcalina da una batteria a secco zinco-carbone?
R: Le batterie alcaline hanno una densità energetica maggiore e una durata più lunga rispetto alle pile a secco zinco-carbone grazie all’uso di un elettrolita alcalino.
D: Qual è la differenza tra le batterie zinco-carbone e quelle alcaline?
R: Le batterie zinco-carbone hanno una capacità energetica inferiore e una durata di vita più breve rispetto alle batterie alcaline a causa delle differenze nell’elettrolito e nella struttura.
D: È possibile utilizzare batterie zinco-carbone invece di batterie alcaline?
R: Sì, ma le batterie zinco-carbone possono avere una durata di vita più breve e sono meno adatte per dispositivi ad alto consumo rispetto alle batterie alcaline.
