Il carbonato di rame (CuCO3) è un composto blu-verde formato naturalmente dalla reazione dei sali di Cu con gli ioni carbonato. Ha varie applicazioni industriali, inclusi pigmenti e fungicidi.
| Nome IUPAC | Carbonato di rame(II). |
| Formula molecolare | CuCO3 |
| numero CAS | 1184-64-1 |
| Sinonimi | Carbonato basico di rame, Carbonato rameico, Monocarbonato di rame |
| InChI | InChI=1S/CH2O3.Cu/c2-1(3)4;/h(H2,2,3,4);/q;+2/p-2 |
Proprietà del carbonato di rame
Formula del carbonato di rame
La formula chimica del carbonato rameico è CuCO3. Rappresenta una combinazione di un atomo di rame (Cu), un atomo di carbonio (C) e tre atomi di ossigeno (O). Questa formula fornisce informazioni cruciali sulla composizione elementare del composto.
Massa molare del carbonato di rame
Il carbonato rameico ha una massa molare di circa 123,55 grammi per mole (g/mol). La massa molare è la somma delle masse atomiche di tutti gli atomi presenti in una mole di sostanza ed è espressa in grammi per mole.
Punto di ebollizione del carbonato di rame
Il carbonato rameico non ha un punto di ebollizione distinto poiché si decompone in CuO e anidride carbonica quando riscaldato a circa 200°C. Pertanto, subisce una decomposizione termica anziché l’ebollizione.
Punto di fusione del carbonato di rame
Il carbonato rameico ha un punto di fusione di circa 200°C (392°F). A questa temperatura il carbonato rameico solido si trasforma allo stato liquido. Tuttavia, va notato che si decompone prima di raggiungere il punto di ebollizione.
Densità del carbonato di rame g/mL
La densità del carbonato rameico è di circa 3,6 grammi per millilitro (g/mL). La densità misura la massa di una sostanza per unità di volume, indicando quanto strettamente le sue particelle sono imballate insieme.
Peso molecolare del carbonato di rame
Il peso molecolare del carbonato rameico, chiamato anche massa molare, è di circa 123,55 g/mol. Questo valore è cruciale per vari calcoli e conversioni chimiche.
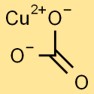
Struttura del carbonato di rame
Il carbonato rameico adotta una struttura planare trigonale. L’atomo centrale di rame è circondato da tre atomi di ossigeno e un gruppo carbonato, composto da un atomo di carbonio e tre atomi di ossigeno legati insieme.
Solubilità del carbonato di rame
Il carbonato rameico è scarsamente solubile in acqua, il che significa che si dissolve solo in misura limitata. La solubilità è influenzata da fattori come la temperatura e il pH. Reagisce con gli acidi per formare sali di rame e rilasciare anidride carbonica.
| Aspetto | Solido blu-verde |
| Peso specifico | ~3,6 g/ml |
| Colore | Blu verde |
| Odore | Inodore |
| Massa molare | ~123,55 g/mole |
| Densità | ~3,6 g/ml |
| Punto di fusione | ~200°C (392°F) |
| Punto di ebollizione | Si decompone a ~200°C |
| Punto flash | Non applicabile |
| solubilità in acqua | Scarsamente solubile, influenzato dalla temperatura e dal pH |
| Solubilità | Insolubile nella maggior parte dei solventi |
| Pressione del vapore | Non applicabile |
| Densità del vapore | Non applicabile |
| pKa | Non applicabile |
| pH | Alcalino (basico) |
Sicurezza e pericoli del carbonato di rame
Il carbonato rameico pone alcune considerazioni sulla sicurezza e sui rischi. È essenziale maneggiarlo con cura per evitare potenziali rischi. Il contatto diretto con la pelle, gli occhi o l’inalazione di polvere può causare irritazione e disagio. L’esposizione o l’ingestione prolungata può essere dannosa e portare a problemi di salute più gravi. Può rilasciare fumi tossici, inclusa anidride carbonica, se riscaldato, richiedendo un’adeguata ventilazione. Inoltre, il carbonato rameico è infiammabile sotto forma di polvere e richiede un’attenta conservazione e manipolazione per evitare rischi di incendio. Per garantire la sicurezza, seguire sempre le precauzioni di sicurezza, indossare dispositivi di protezione adeguati e conservare i composti lontano da materiali incompatibili.
| Simboli di pericolo | Irritante, pericoloso |
| Descrizione della sicurezza | Maneggiare con cura. Evitare il contatto diretto. Utilizzare in aree ben ventilate. Seguire le istruzioni di sicurezza e indossare dispositivi di protezione. |
| Numeri di identificazione delle Nazioni Unite | Non attribuito |
| Codice SA | 2836.40.0000 |
| Classe di pericolo | Non classificato |
| Gruppo di imballaggio | Non applicabile |
| Tossicità | Bassa tossicità; può causare irritazione e disagio al contatto; evitare l’ingestione e l’inalazione. |
Metodi di sintesi del carbonato di rame
Esistono vari metodi per sintetizzare il carbonato rameico, tutti implicano la combinazione di sali di Cu con fonti di carbonato. Un approccio comune consiste nel far reagire CuSO4 con carbonato di sodio (Na2CO3) in una soluzione acquosa. Questa reazione produce un precipitato di carbonato rameico e la filtrazione lo separa, seguita da essiccamento per ottenere il prodotto solido.
Un altro metodo prevede la reazione di CuCl2 con carbonato di sodio o bicarbonato di sodio (NaHCO3) in un ambiente acquoso simile. Questa reazione produce carbonato rameico e cloruro di sodio (NaCl) come sottoprodotto.
Inoltre, il gorgogliamento di anidride carbonica (CO2) attraverso una soluzione di Cu(OH)2 forma un precipitato di carbonato rameico in seguito alla conversione dell’idrossido.
Il metallo Cu interagisce con il gas anidride carbonica in un ambiente controllato per produrre carbonato rameico.
Il controllo delle condizioni di reazione, come la temperatura e la concentrazione, diventa fondamentale per ottenere le rese e la purezza desiderate. Questi metodi forniscono i mezzi per produrre carbonato rameico per varie applicazioni industriali, compreso il suo utilizzo come pigmento, fungicida o in altri processi chimici.
Usi del carbonato di rame
Il carbonato di rame trova applicazioni versatili in vari settori grazie alle sue proprietà uniche. Ecco alcuni usi chiave del carbonato rameico:
- Pigmenti: il carbonato rameico conferisce ampiamente vivaci tonalità blu-verdi a vernici, ceramica e plastica, migliorandone l’aspetto.
- Fungicida agricolo: serve efficacemente come fungicida in agricoltura, proteggendo le colture dalle infezioni fungine e promuovendo una crescita sana delle piante.
- Conservazione del legno: il carbonato di rame viene utilizzato nelle formulazioni di preservanti del legno, proteggendo il legno dalla putrefazione e dai danni degli insetti.
- Galvanotecnica: facilita in modo cruciale i processi di galvanica, consentendo la deposizione di un rivestimento di rame su varie superfici metalliche, migliorando così la conduttività e la resistenza alla corrosione.
- Catalizzatore: il carbonato rameico agisce come catalizzatore attivo in diverse reazioni chimiche, accelerando la velocità di reazione senza subire cambiamenti significativi.
- Alghicida: nel trattamento dell’acqua, funziona attivamente come alghicida, controllando la crescita delle alghe in serbatoi, stagni e sistemi idrici.
- Produzione del vetro: il carbonato di rame contribuisce attivamente alla produzione di prodotti in vetro colorato di verde come bottiglie e vetreria decorativa nell’industria manifatturiera del vetro.
- Gioielli artificiali: la produzione di gioielli artificiali incorpora attivamente il carbonato rameico, fornendo un’alternativa conveniente ai veri gioielli a base di rame.
- Chimica analitica: il carbonato di rame trova un utilizzo attivo come reagente nella chimica analitica per condurre vari test ed esperimenti.
- Fuochi d’artificio e pirotecnici: Contribuisce attivamente al colore verde brillante dei fuochi d’artificio e degli spettacoli pirotecnici.
La diversità delle applicazioni evidenzia l’importanza del carbonato rameico come composto chimico prezioso in molti settori, migliorando sia i prodotti che i processi.
Domande:
D: Quante moli di atomi di ossigeno ci sono in 5,67 moli di carbonato di rame(II)?
R: In 5,67 moli di carbonato di rame(II), ci sono 17,01 moli di atomi di ossigeno (3 atomi di ossigeno per 1 mole di CuCO3).
D: Il carbonato di rame è solubile?
R: Il carbonato rameico è scarsamente solubile in acqua.
D: Quale elemento ha maggiori probabilità di trasmettere elettricità: rame, carbonio, elio o zolfo?
R: Il rame è l’elemento che ha maggiori probabilità di trasmettere l’elettricità perché è un buon conduttore di elettricità.
D: Come produrre il carbonato di rame?
R: Il carbonato rameico può essere preparato facendo reagire i sali di Cu con fonti di carbonato, come il carbonato di sodio, o facendo gorgogliare anidride carbonica attraverso una soluzione di Cu(OH)2.
D: Come utilizzare il carbonato di rame nella ceramica?
R: Il carbonato rameico viene utilizzato in ceramica come smalto ceramico per aggiungere un colore blu-verde ai pezzi finiti.
D: CuCO3 è solubile in acqua?
R: CuCO3 è scarsamente solubile in acqua.
D: Come si potrebbe utilizzare una reazione di precipitazione per preparare un campione di CuCO3?
R: Per preparare CuCO3 mediante una reazione di precipitazione, è possibile mescolare un sale di Cu solubile con un sale di carbonato solubile, portando alla formazione di carbonato rameico insolubile, che può essere separato mediante filtrazione.
D: Qual è il nome del composto CuCO3?
R: Il composto CuCO3 è chiamato carbonato rameico (II).
D: Qual è la massa molare di CuCO3?
R: La massa molare di CuCO3 è di circa 123,55 g/mol.
D: CuCO3 è solubile o insolubile?
R: CuCO3 è insolubile nella maggior parte dei solventi, inclusa l’acqua.
D: Di cosa è fatto il carbonato di rame (II)?
R: Il carbonato di rame (II) è composto da un atomo di Cu, un atomo di carbonio (C) e tre atomi di ossigeno (O).
