Il carbonato di potassio (K2CO3) è una polvere bianca e inodore comunemente utilizzata nella produzione di sapone, vetro e ceramica. Può anche essere utilizzato come additivo alimentare e agente tampone nell’industria farmaceutica.
| Nome dell’IUPAC | Carbonato di potassio |
| Formula molecolare | K2CO3 |
| numero CAS | 584-08-7 |
| Sinonimi | Sale dipotassico dell’acido carbonico; Cenere perlata; Potassa; Sale di tartaro; Monocarbonato di potassio; Carbonato idrogeno di potassio |
| InChI | InChI=1S/CH2O3.2K/c2-1(3)4;;/h(H2,2,3,4);;/q;2*+1/p-2/fCO3.2K/q-2; M |
Proprietà del carbonato di potassio
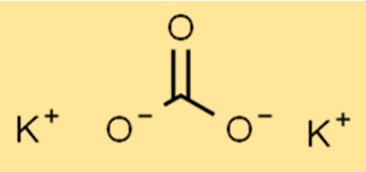
Formula di carbonato di potassio
La formula chimica del carbonato di potassio è K2CO3. Questa formula rappresenta il numero esatto di atomi di ciascun elemento nel composto. La formula può essere utilizzata per calcolare la massa molare e altre proprietà del composto.
Massa molare del carbonato di potassio
K2CO3 ha una massa molare di 138,21 g/mol. Ciò significa che una mole di K2CO3 contiene 138,21 grammi del composto. La massa molare è importante per determinare la quantità di sostanza necessaria per una particolare reazione o esperimento. Viene anche utilizzato per convertire la massa in moli di una sostanza.
Punto di ebollizione del carbonato di potassio
K2CO3 ha un punto di ebollizione relativamente alto di 1.620 ° C (2.948 ° F). Ciò lo rende utile in applicazioni ad alta temperatura come la produzione di vetro e ceramica. Il punto di ebollizione è la temperatura alla quale una sostanza passa dallo stato liquido a quello gassoso.
Punto di fusione del carbonato di potassio
K2CO3 ha un punto di fusione di 891°C (1.636°F). Questo punto di fusione relativamente alto è dovuto alla natura ionica del composto. Quando riscaldato, i legami ionici tra gli ioni potassio e carbonato devono essere rotti affinché la sostanza si sciolga.
Densità del carbonato di potassio g/mL
La densità di K2CO3 è 2,43 g/mL a temperatura ambiente. Ciò significa che un certo volume di K2CO3 ha una certa massa. La densità di una sostanza è una caratteristica importante che può essere utilizzata per identificare la sostanza e calcolare la massa o il volume di una sostanza in un dato spazio.
Peso molecolare del carbonato di potassio
Il peso molecolare di K2CO3 è 138,21 g/mol. Questa è la massa di una mole del composto, che è importante in molti calcoli chimici.
Struttura del carbonato di potassio
K2CO3 ha una struttura ionica, con formula K2CO3. Lo ione potassio (K+) e lo ione carbonato (CO32-) sono tenuti insieme da legami ionici. Lo ione carbonato è uno ione poliatomico composto da un atomo di carbonio e tre atomi di ossigeno.
| Aspetto | Polvere cristallina bianca |
| Densità specifica | 2.43 |
| Colore | Bianco |
| Odore | Inodore |
| Massa molare | 138,21 g/mole |
| Densità | 2,43 g/ml |
| Punto di fusione | 891°C (1.636°F) |
| Punto di ebollizione | 1620°C (2948°F) |
| Punto flash | Non applicabile |
| solubilità in acqua | 112 g/100 ml a 20°C |
| Solubilità | Solubile in acqua, glicerolo e alcool |
| Pressione del vapore | Trascurabile a temperatura ambiente |
| Densità del vapore | Non applicabile |
| pKa | 10:33 |
| pH | 11,5 (soluzione acquosa a 10 g/L) |
Sicurezza e pericoli del carbonato di potassio
K2CO3 è generalmente considerato sicuro per l’uso nell’industria e nei prodotti domestici. Tuttavia, potrebbe essere irritante per la pelle e gli occhi e l’inalazione della polvere può causare irritazione delle vie respiratorie. L’esposizione prolungata ad alte concentrazioni di polvere K2CO3 può causare danni ai polmoni. È importante indossare adeguati dispositivi di protezione individuale durante la manipolazione di questo composto, inclusi guanti, occhiali e una maschera. K2CO3 non è né infiammabile né esplosivo, ma può reagire con gli acidi per produrre anidride carbonica, che può essere pericolosa in spazi ristretti. In caso di ingestione o di contatto con la pelle o gli occhi, consultare immediatamente un medico.
| Simboli di pericolo | Nessuno |
| Descrizione della sicurezza | Indossare guanti, occhiali e una maschera. Evitare il contatto prolungato con la pelle e gli occhi. Non inalare la polvere. |
| Numeri di identificazione delle Nazioni Unite | ONU1863 |
| Codice SA | 2836.40.00 |
| Classe di pericolo | Non pericoloso |
| Gruppo di imballaggio | Non applicabile |
| Tossicità | Il carbonato di potassio non è considerato tossico, ma può causare irritazione respiratoria e cutanea ad alte concentrazioni. L’esposizione prolungata ad alte concentrazioni di polvere può causare danni ai polmoni. |
Metodi di sintesi del carbonato di potassio
Vari metodi possono sintetizzare K2CO3
Un metodo comune consiste nel far reagire l’idrossido di potassio con l’anidride carbonica.
Per impedire la fuoriuscita di anidride carbonica, questa reazione può essere effettuata in un contenitore chiuso.
Un altro metodo prevede la reazione del cloruro di potassio con il carbonato di sodio in una soluzione acquosa. Il K2CO3 risultante precipita dalla soluzione e può essere raccolto mediante filtrazione.
Un altro modo per sintetizzare K2CO3 è far reagire il solfato di potassio con il carbonio in presenza di carbone. Storicamente, i chimici utilizzavano il processo Leblanc per produrre K2CO3 su scala industriale. Tuttavia, le preoccupazioni ambientali hanno reso questo processo raro oggi, perché rilascia anidride solforosa.
K2CO3 può essere sintetizzato dal bicarbonato di potassio riscaldandolo ad alte temperature, provocandone la decomposizione in K2CO3 e anidride carbonica. Un forno o un forno possono effettuare questa reazione.
Usi del carbonato di potassio
K2CO3 ha una vasta gamma di applicazioni in vari settori grazie alle sue proprietà uniche. Alcuni dei suoi usi comuni includono:
- Produzione del vetro: utilizzato come flusso per abbassare il punto di fusione della silice e di altri ingredienti.
- Industria alimentare: utilizzato come additivo alimentare per regolare l’acidità e come agente lievitante nella cottura al forno.
- Sapone e detersivi: utilizzato anche nella produzione di saponi e detersivi come addolcitore dell’acqua.
- Industria farmaceutica: utilizzato come agente tampone nella formulazione di farmaci.
- Fertilizzante: utilizzato anche come fertilizzante in agricoltura per fornire potassio alle piante.
- Produzione ceramica: Utilizzato come fondente per ridurre la temperatura di cottura e migliorare la qualità del prodotto finito.
- Fuochi d’artificio: utilizzati nella produzione di fuochi d’artificio per produrre una fiamma viola.
- Batterie: utilizzate nella produzione di batterie come elettrolita.
- Industria tessile: utilizzato come agente colorante.
Domande:
D: Il carbonato di potassio è solubile?
R: Sì, il carbonato di potassio è solubile in acqua.
D: K2CO3 è solubile in acqua?
R: Sì, K2CO3 è solubile in acqua. Infatti è molto solubile e può sciogliersi in acqua per formare una soluzione limpida e incolore.
D: Quanti grammi di carbonato di potassio sono necessari per preparare 200 ml di una soluzione 2,5 M?
R: Per preparare una soluzione di K2CO3 2,5 M in 200 ml di acqua, dovrai sciogliere 33,25 grammi di K2CO3 in acqua.
Calcolo: Molarità = moli/volume (in litri) 2,5 M = moli / 0,2 L moli = 0,5 moli di massa = moli x massa molare massa = 0,5 mole x 138,21 g/mol massa = 33,25 g
D: Qual è la concentrazione di ioni K in una soluzione di K2CO3 0,045 M presupponendo una dissociazione completa?
R: Quando K2CO3 è completamente dissociato in acqua, forma due ioni K+ e uno ione CO3 2-. Pertanto, la concentrazione di ioni K+ in una soluzione di K2CO3 0,045 M sarebbe il doppio della molarità della soluzione di K2CO3, che è 0,090 M.
