Il carbonato di magnesio (MgCO3) è una sostanza bianca in polvere comunemente usata come antiacido e lassativo. Si trova anche in alcuni cosmetici e dentifrici. Il carbonato di magnesio aiuta a neutralizzare l’eccesso di acido nello stomaco e ad alleviare la stitichezza.
| Nome dell’IUPAC | Carbonato di magnesio |
| Formula molecolare | MgCO3 |
| numero CAS | 546-93-0 |
| Sinonimi | Magnesite, Magnesia carbonica, sale di magnesio, (MgCO3) |
| InChI | InChI=1S/CH2O3.Mg/c2-1(3)4;/h(H2,2,3,4);/q;+2 |
Proprietà del carbonato di magnesio
Formula di carbonato di magnesio
La formula chimica del carbonato di magnesio è MgCO3. Questa formula indica che il carbonato di magnesio contiene uno ione Mg+2 e uno ione CO3 2-. Lo ione CO3 2 è composto da un atomo di C e tre atomi di O. La formula chimica del carbonato di magnesio è una proprietà importante perché identifica la composizione del carbonato di magnesio e dei suoi elementi costitutivi.
Massa molare del carbonato di magnesio
La massa molare di MgCO3 è 84,31 g/mol. Questo valore si ottiene sommando le masse atomiche degli atomi di magnesio, carbonio e ossigeno in una mole di MgCO3. La massa molare è un’importante proprietà fisica di MgCO3 perché viene utilizzata in vari calcoli come la determinazione del numero di moli di MgCO3 in un dato campione.
Punto di ebollizione del carbonato di magnesio
Il MgCO3 non ha un punto di ebollizione definito perché si decompone prima di raggiungere il punto di ebollizione. Quando riscaldato, MgCO3 si decompone per formare ossido di magnesio e anidride carbonica. La decomposizione del MgCO3 avviene ad una temperatura di circa 350°C.
Carbonato di magnesio Punto di fusione
Il punto di fusione del MgCO3 è 990°C. A questa temperatura, MgCO3 si scioglie e subisce la decomposizione per formare ossido di magnesio e anidride carbonica. Il punto di fusione del MgCO3 è una proprietà fisica importante perché determina la temperatura alla quale il MgCO3 può essere fuso e lavorato.
Densità del carbonato di magnesio g/mL
La densità di MgCO3 è 2,958 g/mL. Questo valore si ottiene dividendo la massa di una mole di MgCO3 per il suo volume. La densità di MgCO3 è una proprietà fisica importante perché viene utilizzata in varie applicazioni come la determinazione della galleggiabilità di MgCO3 in una determinata soluzione.
Peso molecolare del carbonato di magnesio
Il peso molecolare di MgCO3 è 84,31 g/mol. Questo valore si ottiene sommando le masse atomiche degli atomi di magnesio, carbonio e ossigeno in una molecola di MgCO3. Il peso molecolare di MgCO3 è una proprietà fisica importante perché viene utilizzato in vari calcoli come la determinazione della quantità di MgCO3 richiesta per una determinata reazione chimica.
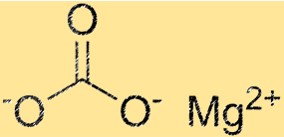
Struttura del carbonato di magnesio
MgCO3 ha una struttura cristallina trigonale. Lo ione magnesio si trova al centro della struttura ed è circondato da sei ioni carbonato. Gli ioni carbonato sono disposti secondo uno schema esagonale attorno allo ione magnesio. La struttura cristallina di MgCO3 è una proprietà importante perché ne determina le proprietà fisiche e chimiche.
| Aspetto | Solido bianco |
| Densità specifica | 2.958 g/ml |
| Colore | Bianco |
| Odore | Inodore |
| Massa molare | 84,31 g/mole |
| Densità | 2.958 g/ml |
| Punto di fusione | 990°C |
| Punto di ebollizione | Si decompone prima di raggiungere il punto di ebollizione |
| Punto flash | Non applicabile |
| solubilità in acqua | 0,02 g/l (15°C) |
| Solubilità | Solubile negli acidi, insolubile in acqua |
| Pressione del vapore | Non applicabile |
| Densità del vapore | Non applicabile |
| pKa | 10.3 |
| pH | 9.2-10.2 |
Sicurezza e pericoli del carbonato di magnesio
MgCO3 è considerato un composto sicuro. Non è infiammabile, esplosivo o tossico. Tuttavia, come qualsiasi altro composto chimico, deve essere maneggiato con cura. L’inalazione di polvere di MgCO3 può causare irritazione respiratoria. Quando si maneggia MgCO3, si raccomanda di indossare adeguati dispositivi di protezione individuale come guanti e occhiali di sicurezza. MgCO3 deve essere conservato in un luogo fresco e asciutto, lontano da fonti di calore e ignizione. Il MgCO3 versato deve essere pulito immediatamente e smaltito adeguatamente. È importante seguire le opportune precauzioni di sicurezza durante la manipolazione di MgCO3 per evitare potenziali pericoli.
| Simboli di pericolo | Nessuno |
| Descrizione della sicurezza | Non classificato come pericoloso |
| Numeri di identificazione delle Nazioni Unite | Non applicabile |
| Codice SA | 2836.60.00 |
| Classe di pericolo | Non classificato come pericoloso |
| Gruppo di imballaggio | Non applicabile |
| Tossicità | Bassa tossicità, non considerato un rischio significativo per la salute se maneggiato correttamente |
Metodi di sintesi del carbonato di magnesio
Esistono diversi metodi per sintetizzare MgCO3, inclusa la precipitazione e la decomposizione termica.
Per formare MgCO3 utilizzando il metodo di precipitazione, si aggiunge un sale di magnesio solubile (come cloruro di magnesio o nitrato di magnesio) a una soluzione contenente un carbonato solubile (come carbonato di sodio o nitrato di magnesio). carbonato di ammonio). Quindi mescolare la miscela risultante e lasciarla riposare. Ciò fa sì che MgCO3 precipiti fuori dalla soluzione. Successivamente filtrare il precipitato, lavarlo e asciugarlo.
Per ottenere MgCO3 mediante il metodo di decomposizione termica, l’idrossido di magnesio o l’ossido di magnesio vengono riscaldati introducendo anidride carbonica. Questa reazione porta alla formazione di MgCO3 e vapore acqueo. Il passo successivo è raccogliere, purificare ed essiccare il MgCO3.
Un altro metodo per sintetizzare MgCO3 è quello di far reagire solfato di magnesio e carbonato di sodio . L’acqua dissolve i due composti e poi li mescola, facendo precipitare il MgCO3 dalla soluzione. Il processo quindi raccoglie, lava e asciuga il precipitato.
Usi del carbonato di magnesio
MgCO3 è un composto versatile con vari usi in diversi settori. Ecco alcuni dei suoi usi:
- Integratore alimentare: utilizzato come integratore alimentare per la sua capacità di fornire all’organismo il magnesio essenziale.
- Antiacido: usato come antiacido per trattare il bruciore di stomaco e l’indigestione.
- Applicazioni industriali: utilizzato in diverse applicazioni industriali, come nella produzione di ceramica, vetro e cemento.
- Cosmetici: Utilizzato nei cosmetici come agente rigonfiante, assorbente e opacizzante.
- Ritardante di fiamma: utilizzato come ritardante di fiamma in diverse applicazioni, inclusi materiali isolanti, tessili e plastica.
- Prodotti farmaceutici: utilizzati nella produzione di vari prodotti farmaceutici, come lassativi e antiacidi.
- Industria alimentare: utilizzato come additivo alimentare per regolare l’acidità dei prodotti alimentari e come agente antiagglomerante.
- Attrezzatura sportiva: utilizzata nelle attrezzature sportive, come il gesso da palestra, per migliorare la presa ed evitare scivolamenti.
Domande:
D: Il carbonato di magnesio è solubile in acqua?
R: MgCO3 ha una bassa solubilità in acqua. A temperatura ambiente, in 100 ml di acqua si possono sciogliere solo circa 0,02 grammi di MgCO3.
D: MgCO3 è solubile?
R: MgCO3 ha una bassa solubilità in acqua, il che significa che non è molto solubile.
D: Cosa si forma quando reagiscono acido acetico e MgCO3?
R: Quando l’acido acetico e il MgCO3 reagiscono, formano acetato di magnesio, acqua e anidride carbonica. L’equazione chimica bilanciata per questa reazione è MgCO3 + 2CH3COOH → Mg(CH3COO)2 + H2O + CO2.
D: La solubilità molare di MgCO3 è 1,8 × 10–4 mol/L. Cos’è Ksp per questo composto?
A: Valore Ksp per MgCO3 utilizzando la solubilità molare:
Ksp = [Mg2+][CO32-], dove [Mg2+] è uguale alla solubilità molare e anche [CO32-] è uguale alla solubilità molare. Pertanto, Ksp = (1,8 × 10–4 mol/L)2 = 3,24 × 10–9.
D: Quale dei seguenti è un prodotto che si forma durante la decomposizione di MgCO3?
R: Quando MgCO3 si decompone, forma ossido di magnesio (MgO) e anidride carbonica (CO2).
D: Qual è l’equazione chimica bilanciata per la reazione utilizzata per calcolare ΔH°f di MgCO3(s)?
R: L’equazione chimica bilanciata della reazione utilizzata per calcolare l’entalpia standard di formazione (ΔH°f) di MgCO3(s) è: Mg(s) + CO2(g) → MgCO3(s).
