Il benzene o C6H6 è un liquido incolore, altamente infiammabile con un odore dolce. Viene utilizzato nella produzione di plastica, fibre sintetiche, gomma, pesticidi e altri prodotti chimici. È un noto cancerogeno e può causare problemi di salute.
| Nome dell’IUPAC | Benzene |
| Formula molecolare | C6H6 |
| numero CAS | 71-43-2 |
| Sinonimi | Benzolo, fene, annulene, cicloesatriene, ecc. |
| InChI | InChI=1S/C6H6/c1-2-4-6-5-3-1/h1-6H |
Proprietà del benzene
Massa molare del benzene
Il benzene ha una massa molare di 78,11 g/mol. È un composto organico ciclico composto da sei atomi di carbonio e sei atomi di idrogeno. La massa molare del benzene si calcola sommando le masse atomiche dei suoi atomi costituenti, che sono 12,01 g/mol per il carbonio e 1,01 g/mol per l’idrogeno. Il benzene è ampiamente utilizzato nell’industria chimica come materia prima per la produzione di molti composti importanti. La massa molare del benzene è importante per determinare la quantità di composto necessaria per reazioni e altre applicazioni.
Formula del benzene
Il benzene ha la formula chimica C6H6. Questa formula rappresenta il numero e il tipo di atomi presenti nella molecola. La formula del benzene è importante per determinare le sue proprietà fisiche e chimiche, nonché la sua reattività nelle reazioni chimiche. La formula del benzene viene utilizzata anche per denominare e identificare il composto in vari contesti, come nella letteratura chimica e nei documenti normativi.
Punto di ebollizione del benzene
Il benzene ha un punto di ebollizione di 80,1°C o 176,2°F. Questo è relativamente basso rispetto ad altri composti organici di peso molecolare simile. Il punto di ebollizione di C6H6 è dovuto alle sue forze di attrazione intermolecolari, in particolare alle forze di Van der Waals. All’aumentare della temperatura aumenta anche l’energia cinetica delle molecole, portando infine alla rottura di queste forze intermolecolari e alla transizione dalla fase liquida a quella gassosa. Il basso punto di ebollizione di C6H6 lo rende utile nelle applicazioni in cui è necessario rimuovere il composto mediante evaporazione.
Punto di fusione del benzene
C6H6 ha un punto di fusione di 5,5°C o 41,9°F. Questo è relativamente basso rispetto ad altri composti aromatici di peso molecolare simile. Il punto di fusione di C6H6 è dovuto alla sua struttura molecolare, che consiste in un anello planare di atomi di carbonio con doppi legami alternati. La disposizione degli elettroni nell’anello conferisce a C6H6 la sua caratteristica stabilità e lo rende resistente a molte reazioni chimiche. Il basso punto di fusione di C6H6 lo rende utile nelle applicazioni in cui è necessario fondere il composto per ulteriori lavorazioni.
Densità del benzene g/ml
Il benzene ha una densità di 0,879 g/mL a temperatura ambiente (25°C o 77°F). La densità del benzene è una misura della massa per unità di volume del composto. La bassa densità del benzene lo rende utile nelle applicazioni in cui è richiesto un solvente a bassa densità, come nella separazione di composti in base alla loro densità.
Peso molecolare del benzene
Il benzene ha un peso molecolare di 78,11 g/mol. Il peso molecolare del benzene è la somma dei pesi atomici dei suoi atomi costituenti. Il peso molecolare del benzene è importante per determinare la stechiometria delle reazioni e per determinare la concentrazione di benzene nelle soluzioni.
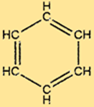
Struttura del benzene
C6H6 ha una struttura unica costituita da un anello esagonale di atomi di carbonio, ciascuno legato ad altri due atomi di carbonio e un atomo di idrogeno. I doppi legami alternati nell’anello conferiscono a C6H6 la sua caratteristica stabilità e lo rendono resistente a molte reazioni chimiche. La struttura di C6H6 lo rende anche una materia prima utile per la produzione di molti composti importanti.
| Aspetto | Liquido incolore |
| Peso specifico | 0,879 g/ml |
| Colore | Incolore |
| Odore | Morbido |
| Massa molare | 78,11 g/mole |
| Densità | 0,879 g/ml |
| Punto di fusione | 5,5°C (41,9°F) |
| Punto di ebollizione | 80,1°C (176,2°F) |
| Punto flash | -11°C (12,2°F) |
| solubilità in acqua | 1,79 g/l |
| Solubilità | Insolubile in acqua, solubile in solventi organici |
| Pressione del vapore | 12,1 kPa a 20°C |
| Densità del vapore | 2,8 (aria=1) |
| pKa | 43.2 |
| pH | Neutro |
Sicurezza e pericoli del benzene
C6H6 è un composto altamente infiammabile e tossico che comporta rischi significativi per la salute umana e l’ambiente. È un noto cancerogeno e può causare leucemia, anemia aplastica e altri disturbi del sangue negli esseri umani. L’esposizione a C6H6 può avvenire attraverso inalazione, contatto con la pelle o ingestione e può provocare effetti acuti e cronici sulla salute. È importante maneggiare C6H6 con adeguate precauzioni di sicurezza, tra cui un’adeguata ventilazione, indumenti protettivi e protezione respiratoria. Anche C6H6 deve essere conservato e smaltito in conformità con le normative locali per ridurre al minimo la contaminazione ambientale e i rischi per la salute pubblica.
| Simboli di pericolo | Teschio e Ossa Incrociate, Fiamma |
| Descrizione della sicurezza | Facilmente infiammabile, tossico, cancerogeno, nocivo per ingestione, irritante |
| Identificatori AN | ONU 1114 (Benzene), ONU 1992 (Liquidi infiammabili e tossici) |
| Codice SA | 2902.20.00 |
| Classe di pericolo | 3 (Liquidi infiammabili), 6.1 (Sostanze tossiche), 8 (Sostanze corrosive) |
| Gruppo di imballaggio | II (Benzene), III (Liquidi infiammabili e tossici) |
| Tossicità | Tossicità acuta: Molto tossico (LD50: 2,5 g/kg per via orale, 0,44 mg/L per inalazione), Tossicità cronica: Cancerogeno, Mutageno, Tossicità riproduttiva |
Metodi di sintesi del benzene
Esistono diversi metodi per sintetizzare il benzene, un’importante sostanza chimica industriale utilizzata nella produzione di plastica, gomma e prodotti farmaceutici.
Un metodo comune è il reforming catalitico della nafta di petrolio, che prevede il riscaldamento della nafta ad alte temperature in presenza di un catalizzatore, come platino o renio, per produrre una miscela di idrocarburi aromatici, compreso il benzene.
Un altro metodo è l’idrodealchilazione del toluene, che prevede la reazione del toluene con l’idrogeno in presenza di un catalizzatore, come l’ossido di cromo o l’ossido di molibdeno, per rimuovere il gruppo metilico e formare benzene.
La pirolisi degli idrocarburi, come carbone o petrolio, ad alte temperature in assenza di ossigeno sintetizza il benzene. Questo processo porta alla formazione di una miscela di idrocarburi aromatici, compreso il benzene.
Altri metodi per sintetizzare il benzene includono la reazione dell’acetilene con se stesso in presenza di un catalizzatore, come il rame, per formare benzene, nonché la reazione del fenolo con formaldeide in presenza di un catalizzatore acido, come l’acido solforico, per formare benzene. formare benzene. produrre benzene.
Ciascuno di questi metodi presenta vantaggi e svantaggi, a seconda di fattori quali costo, efficacia e impatto ambientale. La scelta del metodo di sintesi del benzene dipenderà dall’applicazione specifica e dai requisiti del processo di produzione.
Usi del benzene
Il benzene è un prodotto chimico industriale versatile e importante con un’ampia gamma di applicazioni in vari settori. Alcuni degli usi principali del benzene sono:
- Produzione di plastica: utilizzata nella produzione di vari tipi di plastica, tra cui polistirolo, poliuretano e nylon.
- Produzione di gomma: i produttori di gomma sintetica la utilizzano nella loro produzione. I produttori utilizzano quindi questa gomma sintetica per creare pneumatici, tubi, cinture e altri prodotti in gomma.
- Produzione farmaceutica: utilizzata come materia prima per la produzione di vari prodotti farmaceutici, inclusi antibiotici, antistaminici e analgesici.
- Solvente: utilizzato come solvente per un’ampia gamma di composti organici, inclusi grassi, oli, resine e cere.
- Carburante: utilizzato come additivo per carburanti ad alto numero di ottano, migliorando le prestazioni dei motori a benzina.
- Estrazione dell’olio: utilizzato nell’estrazione di oli, come oli vegetali e oli essenziali, dalle piante.
- Adesivi: utilizzati nella produzione di adesivi, come cemento gommoso e cemento a contatto.
- Coloranti: utilizzati nella produzione di vari tipi di coloranti, compresi i coloranti sintetici utilizzati nell’industria tessile.
Domande:
D: Il benzene è polare?
R: No, il benzene è una molecola non polare perché ha una struttura simmetrica e le polarità dei singoli legami si annullano.
D: A cosa serve il benzene?
R: Il benzene viene utilizzato nella produzione di vari materiali, tra cui plastica, gomma, prodotti farmaceutici, solventi, additivi per carburanti, adesivi e coloranti.
D: Quale composto condurrà l’elettricità quando disciolto in acqua? CH4, CuSO4, C6H6 o C6H12O6?
R: CuSO4 conduce elettricità quando disciolto in acqua perché si dissocia in ioni, consentendo il flusso della corrente elettrica.
D: C6H6 è polare o non polare?
R: C6H6, noto anche come benzene, è una molecola non polare perché ha una struttura simmetrica e le polarità dei singoli legami si annullano.
D: C6H6 è solubile in acqua?
R: No, C6H6 non è solubile in acqua perché è una molecola non polare e non interagisce bene con solventi polari come l’acqua.
