L’1-bromobutano è un composto organico liquido incolore con la formula molecolare C4H9Br. È utilizzato come agente alchilante nella sintesi organica e come solvente nell’industria.
| Nome IUPAC | Bromuro di butile |
| Formula molecolare | C4H9Br |
| numero CAS | 109-65-9 |
| Sinonimi | 1-bromobutano, n-butil bromuro, butil bromuro, bromobutano, butano, 1-bromo-, 109-65-9, 1-brombutano, 1-bromobutano, n-C4H9Br |
| InChI | InChI=1S/C4H9Br/c1-2-3-4-5/h2-4H2.1H3 |
Massa molare di 1-bromobutano
La massa molare dell’1-bromobutano è 137,03 g/mol. Per ottenere la massa molare dell’1-bromobutano, aggiungiamo le masse atomiche di carbonio, idrogeno e bromo in un’unica molecola. I calcoli chimici spesso richiedono la conversione della massa di una sostanza nel suo numero di moli e la massa molare è essenziale per questa conversione.
Densità dell’1-bromobutano g/ml
La densità dell’1-bromobutano è 1,27 g/mL a 25°C (77°F). Questa è la massa per unità di volume della sostanza. La densità dell’1-bromobutano è maggiore di quella dell’acqua, consentendone la facile separazione dalle soluzioni acquose.
Punto di ebollizione dell’1-bromobutano
Il punto di ebollizione dell’1-bromobutano è 101°C (214°F). È la temperatura alla quale la pressione di vapore del liquido è uguale alla pressione esterna. È una misura della forza delle forze intermolecolari nel liquido. Il punto di ebollizione dell’1-bromobutano lo rende un utile solvente e reagente in chimica organica.
Punto di fusione di C4H9Br
Il punto di fusione di C4H9Br è -112°C (-170°F). È la temperatura alla quale le fasi solida e liquida della sostanza sono in equilibrio. Il punto di fusione dipende dall’intensità delle forze intermolecolari presenti nel solido. Il basso punto di fusione di C4H9Br lo rende un liquido a temperatura ambiente e ne consente una facile manipolazione.
Peso molecolare C4H9Br
Il peso molecolare di C4H9Br è 137,03 g/mol. È la somma dei pesi atomici di tutti gli atomi della molecola. Il peso molecolare viene utilizzato per calcolare la quantità di una sostanza necessaria per una reazione o per determinare la quantità di prodotto ottenuto.
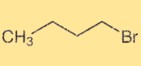
Struttura 1-bromobutano
L’1-bromobutano ha una struttura alchilica a catena lineare con un atomo di bromo attaccato al quarto atomo di carbonio. È un composto organico con la formula chimica C4H9Br. La struttura dell’1-bromobutano ne determina le proprietà fisiche e chimiche e la sua reattività nelle reazioni organiche.
Formula 1-bromobutano
La formula dell’1-bromobutano è C4H9Br. Questo mostra il numero e il tipo di atomi presenti nella molecola. La formula dell’1-bromobutano è importante per determinare la sua reattività e il comportamento nelle reazioni chimiche.
| Aspetto | Liquido incolore |
| Peso specifico | 1,27 a 25°C |
| Colore | Incolore |
| Odore | Odore caratteristico e dolce |
| Massa molare | 137,03 g/mole |
| Densità | 1,27 g/ml a 25°C |
| Punto di fusione | -112°C |
| Punto di ebollizione | 101°C |
| Punto flash | 25°C |
| solubilità in acqua | Leggermente solubile |
| Solubilità | Solubile in etanolo, etere, cloroformio |
| Pressione del vapore | 10 mmHg a 25°C |
| Densità del vapore | 4.6 |
| pKa | 16.5 |
| pH | Neutro |
1-Bromobutano Sicurezza e pericoli
1-bromobutano è una sostanza chimica pericolosa che deve essere maneggiata con cautela. È tossico se ingerito o inalato e può causare irritazione alla pelle e agli occhi al contatto. La sostanza chimica è anche infiammabile e può rappresentare un pericolo di incendio se esposta a calore, scintille o fiamme. È importante indossare dispositivi di protezione adeguati come guanti, occhiali e camice da laboratorio quando si maneggia l’1-bromobutano. La sostanza chimica deve essere conservata in un’area fresca, asciutta e ben ventilata e tenuta lontana da fonti di ignizione. In caso di esposizione accidentale, lavare immediatamente l’area interessata con acqua e consultare un medico per risciacquare.
| Simboli di pericolo | T, F |
| Descrizione della sicurezza | Tenere lontano da fonti di calore, scintille e fiamme. Indossare guanti protettivi/proteggere gli occhi/il viso. IN CASO DI INALAZIONE: trasportare la vittima all’aria aperta e mantenerla a riposo in una posizione che favorisca la respirazione. IN CASO DI INGESTIONE: chiamare un CENTRO ANTIVELENI o un medico se non ci si sente bene. Sciacquati la bocca. Conservare in un’area ben ventilata. Stai calmo. Smaltire il contenuto/contenitore in conformità con le normative locali/regionali/nazionali/internazionali. |
| Identificatori AN | UN1126 |
| Codice SA | 290339 |
| Classe di pericolo | 3 |
| Gruppo di imballaggio | II |
| Tossicità | Tossico se ingerito o inalato. Può causare irritazione alla pelle e agli occhi. |
Metodi per la sintesi dell’1-bromobutano
C4H9Br può essere sintetizzato mediante la reazione di 1-butanolo e acido bromidrico (HBr) in presenza di acido solforico (H2SO4) come catalizzatore. Questa è chiamata reazione di alogenazione catalizzata da acido. La reazione procede come segue:
- L’HBr viene aggiunto all’1-butanolo in presenza di acido solforico.
- HBr protona il gruppo ossidrile dell’1-butanolo, creando un buon gruppo uscente (acqua).
- Il gruppo uscente (acqua) viene sostituito dallo ione bromuro (Br-) di HBr, formando C4H9Br.
- La miscela di reazione viene quindi riscaldata per distillare il C4H9Br.
Un altro metodo per sintetizzare C4H9Br prevede la reazione del butene con acido bromidrico in presenza di un iniziatore di perossido come il perossido di benzoile o il perossido di t-butile. Questa è chiamata reazione di alogenazione dei radicali liberi. La reazione procede come segue:
- Il butene viene aggiunto a una miscela di acido bromidrico e un iniziatore di perossido.
- L’iniziatore del perossido subisce la scissione omolitica, producendo due radicali reattivi.
- I radicali attaccano il doppio legame del butene, formando un radicale bromuro e un radicale centrato sul carbonio.
- Il radicale bromuro reagisce quindi con il radicale centrato sul carbonio, formando C4H9Br.
Entrambi questi metodi sono ampiamente utilizzati per la sintesi di C4H9Br e possono essere ottimizzati per produrre rese elevate del prodotto. Tuttavia, è importante seguire le opportune precauzioni di sicurezza quando si lavora con sostanze chimiche pericolose come HBr e perossidi.
Usi dell’1-bromobutano
C4H9Br è una sostanza chimica versatile utilizzata in varie applicazioni industriali e di laboratorio.
- I chimici organici utilizzano C4H9Br come materia prima per sintetizzare altri composti organici, in particolare per la produzione di prodotti farmaceutici e agrochimici.
- Le reazioni chimiche richiedono C4H9Br come solvente e funge da reagente nella sintesi organica.
- I produttori incorporano C4H9Br in aromi, fragranze e altri composti aromatici. Inoltre, è un componente della produzione di tensioattivi, ampiamente utilizzato nei detergenti come detersivi e saponi.
- C4H9Br funziona come un potenziatore di ottano negli additivi della benzina e viene utilizzato nella produzione di refrigeranti e polimeri.
- Le tecniche analitiche come la gascromatografia richiedono C4H9Br come materiale di riferimento standard di laboratorio. I laboratori didattici e di ricerca di chimica organica lo utilizzano come materia prima per vari esperimenti.
Nel complesso, le proprietà versatili di C4H9Br lo rendono un prodotto chimico importante nei campi chimico, farmaceutico e industriale, con un’ampia gamma di applicazioni nella sintesi organica, nella produzione e nella ricerca.
Domande:
Il tuo compito è convertire il 2-bromobutano in 1-butene con la massima resa. Che reagenti utilizzeresti?
Per convertire il 2-bromobutano in 1-butene con la massima resa, utilizzerei una base forte come l’etossido di sodio (NaOEt) in etanolo come reagente. La reazione procederebbe come una reazione di eliminazione nota come reazione di deidroalogenazione.
La reazione sarebbe la seguente:
- Il 2-bromobutano viene aggiunto ad una soluzione di etossido di sodio in etanolo.
- La base forte estrae un protone dal carbonio beta adiacente al bromo, formando uno ione alcossido intermedio.
- Lo ione alcossido intermedio subisce l’eliminazione del gruppo uscente (bromo), con conseguente formazione dell’alchene (1-butene) e del bromuro di sodio.
- La miscela di reazione viene quindi distillata per rimuovere il prodotto 1-butene.
Utilizzando una base forte come NaOEt, la reazione può essere guidata verso la formazione di 1-butene e, utilizzando l’etanolo come solvente, la reazione può essere condotta in modo relativamente sicuro ed economico. Inoltre, l’uso di una base forte e di etanolo come solvente può portare a rese elevate di 1-butene.
Perché iniziare con 1-bromobutano per il tuo nai nel test dell’acetone?
Iniziare con C4H9Br per il NAI nel test dell’acetone è un modo utile per determinare se un dato composto organico contiene o meno un atomo di alogeno. Il test prevede l’aggiunta di ioduro di sodio (NaI) al composto organico sciolto in acetone, seguita dall’aggiunta di una piccola quantità di cloro o iodio.
La reazione avviene secondo il seguente meccanismo:
- Al composto organico sciolto in acetone viene aggiunto NaI, portando alla formazione del sale di alogenuro di sodio e del corrispondente alogenuro organico.
- L’aggiunta di una piccola quantità di cloro o iodio porta alla formazione di una piccola quantità di gas alogeno, che reagisce con l’alogenuro di sodio per formare il corrispondente gas alogeno.
- Il gas alogeno reagisce quindi con l’alogenuro organico per formare un precipitato colorato, indicando la presenza dell’alogeno nel composto organico originale.
C4H9Br è un composto comunemente usato per questo test perché è un composto organico semplice e facilmente accessibile che contiene un atomo di alogeno (bromo). Inoltre reagisce facilmente con lo ioduro di sodio e il gas alogeno per formare un precipitato colorato, rendendolo un composto di prova utile per rilevare la presenza di un alogeno in altri composti organici.
