L’etanolo o C2H6O è un alcol incolore e infiammabile derivato da materiali vegetali, spesso utilizzato come biocarburante o solvente. È anche un ingrediente comune nelle bevande alcoliche.
| Nome IUPAC | Etanolo |
| Formula molecolare | C2H6O |
| numero CAS | 64-17-5 |
| Sinonimi | Alcool etilico, alcool di grano, EtOH, alcool |
| InChI | InChI=1S/C2H6O/c1-2-3/h3H,2H2,1H3 |
Proprietà dell’etanolo
Struttura di Lewis C2H6O
La struttura di Lewis per C2H6O (noto anche come etanolo) può essere disegnata come segue:
HH
| |
HCCOH
| |
HH
In questa struttura i due atomi di carbonio sono legati tra loro da un unico legame covalente. Ogni atomo di carbonio è anche legato a tre atomi di idrogeno e un atomo di carbonio è legato a un atomo di ossigeno. L’atomo di ossigeno è legato all’atomo di carbonio da un singolo legame covalente e ha due coppie di elettroni liberi.
Questa struttura soddisfa la regola dell’ottetto, secondo la quale ciascun atomo della molecola deve avere otto elettroni nel suo guscio di valenza. Gli atomi di carbonio hanno quattro elettroni nel loro guscio di valenza, mentre gli atomi di idrogeno hanno un elettrone ciascuno. L’atomo di ossigeno ha sei elettroni di valenza e, con due coppie solitarie aggiuntive, soddisfa la regola dell’ottetto.
C2H6O Massa molare
L’etanolo ha una massa molare di circa 46,07 g/mol. La massa molare di una sostanza è definita come la massa di una mole di quella sostanza. Nel caso dell’etanolo, una mole di etanolo contiene circa 46,07 grammi di sostanza. La massa molare è un parametro utile nei calcoli chimici perché consente la conversione tra la massa e le moli di una sostanza.
Punto di ebollizione dell’etanolo
L’etanolo ha un punto di ebollizione di circa 78,5°C (173,3°F) a pressione standard. Questo punto di ebollizione relativamente basso facilita l’evaporazione dell’etanolo, utile in molti processi industriali. Ad esempio, l’etanolo è comunemente usato come solvente nella produzione di prodotti farmaceutici, profumi e altri prodotti chimici.
Punto di fusione dell’etanolo
L’etanolo ha un punto di fusione di circa -114,1°C (-173,4°F). Questo basso punto di fusione rende l’etanolo un liquido a temperatura ambiente, motivo per cui viene comunemente utilizzato in forma liquida come solvente o combustibile. Il punto di fusione dell’etanolo è inferiore a quello dell’acqua, consentendo l’utilizzo dell’etanolo come antigelo nei sistemi di raffreddamento delle automobili.
Densità di etanolo g/mL
La densità dell’etanolo è di circa 0,789 g/mL a temperatura e pressione standard. Ciò significa che un millilitro di etanolo pesa 0,789 grammi. La densità dell’etanolo è inferiore a quella dell’acqua, che ha una densità di 1 g/ml a temperatura e pressione standard. Ciò significa che l’etanolo galleggerà sulla superficie dell’acqua.
Peso molecolare dell’etanolo
Il peso molecolare dell’etanolo è di circa 46,07 g/mol. Il peso molecolare è la somma dei pesi atomici di tutti gli atomi presenti in una molecola. Nel caso dell’etanolo, contiene due atomi di carbonio, sei atomi di idrogeno e un atomo di ossigeno. Il peso molecolare viene utilizzato per calcolare il numero di moli di una sostanza in una data massa della sostanza.
Struttura dell’etanolo
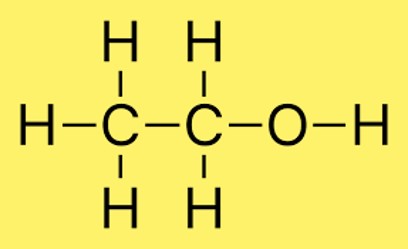
Nella struttura dell’etanolo, due atomi di carbonio si legano tramite un legame singolo e tre atomi di idrogeno si legano a ciascun atomo di carbonio. Inoltre, un atomo di idrogeno è legato all’atomo di ossigeno. La disposizione degli atomi nella molecola è comunemente rappresentata da CH3CH2OH.
Formula dell’etanolo
La formula chimica dell’etanolo è C2H6O. Questa formula mostra il numero e il tipo di atomi nella molecola. La formula può essere utilizzata per calcolare il peso molecolare dell’etanolo, nonché il numero di moli di etanolo in una data massa della sostanza. La formula è utile anche per prevedere il comportamento chimico dell’etanolo nelle reazioni con altri prodotti chimici.
| Aspetto | Liquido incolore |
| Peso specifico | 0,789 |
| Colore | Incolore |
| Odore | Odore caratteristico |
| Massa molare | 46,07 g/mole |
| Densità | 0,789 g/ml |
| Punto di fusione | -114,1°C (-173,4°F) |
| Punto di ebollizione | 78,5°C (173,3°F) a pressione standard |
| Punto flash | 13°C (55°F) |
| solubilità in acqua | Miscibile |
| Solubilità | Solubile in solventi polari e apolari |
| Pressione del vapore | 44,6 kPa a 20°C |
| Densità del vapore | 1,59 (aria = 1) |
| pKa | da 15,9 a 25°C |
| pH | 7 (neutro) |
Sicurezza e pericoli dell’etanolo
L’etanolo è un liquido infiammabile e può comportare pericolo di incendio ed esplosione se non maneggiato correttamente. I vapori di etanolo possono anche accendersi facilmente e rappresentare un grave pericolo di incendio. L’etanolo può anche essere dannoso se ingerito e un consumo eccessivo può portare ad avvelenamento da alcol. L’inalazione di grandi quantità di vapori di etanolo può causare vertigini, mal di testa e nausea. L’esposizione prolungata all’etanolo può anche causare irritazione e secchezza della pelle. L’etanolo deve essere conservato in un’area fresca e ben ventilata, lontano da fonti di ignizione e sostanze incompatibili. Quando si maneggia l’etanolo è necessario utilizzare dispositivi di protezione adeguati, come guanti e occhiali di sicurezza.
| Simboli di pericolo | F, Xi, Flam. Liq. 2 |
| Descrizione della sicurezza | Tenere lontano da fonti di calore, scintille, fiamme libere e superfici calde. Vietato fumare. Utilizzare apparecchiature elettriche, di ventilazione e di illuminazione a prova di esplosione. Evitare di respirare i vapori. Indossare guanti protettivi, occhiali protettivi. In caso di incendio: utilizzare polvere chimica secca, CO2, acqua nebulizzata o schiuma per estinguere. Smaltire il contenuto/contenitore in conformità con le normative locali/regionali/nazionali/internazionali. |
| Identificatori AN | UN1170 |
| Codice SA | 2207.10.00 |
| Classe di pericolo | 3 |
| Gruppo di imballaggio | II |
| Tossicità | L’etanolo può essere tossico se ingerito o inalato in grandi quantità. L’esposizione prolungata può anche causare irritazione e secchezza della pelle. L’ingestione cronica può portare all’alcolismo e ad altri problemi di salute. |
Metodi di sintesi dell’etanolo
L’etanolo può essere sintetizzato con vari metodi, tra cui la fermentazione, l’idratazione diretta dell’etilene e la conversione della biomassa.
La fermentazione è il metodo più comune per produrre etanolo e comporta la conversione di zuccheri e altri carboidrati in etanolo da parte di microrganismi come il lievito. Questo processo viene utilizzato per produrre etanolo da colture come mais, orzo e canna da zucchero, nonché da materiali di scarto come rifiuti alimentari e residui agricoli.
L’idratazione diretta dell’etilene è un altro metodo per produrre etanolo. In questo processo, l’etilene reagisce con l’acqua in presenza di un catalizzatore come l’acido fosforico per formare etanolo. Questo metodo è comunemente usato in ambienti industriali ed è più efficiente della fermentazione.
La conversione della biomassa è un altro metodo per produrre etanolo e prevede la conversione di materiali vegetali come trucioli di legno, erba e residui agricoli in etanolo. Il processo prevede la scomposizione della cellulosa e dell’emicellulosa presenti nel materiale vegetale in zuccheri semplici che possono essere fermentati in etanolo.
Altri metodi per produrre etanolo includono la conversione catalitica dell’anidride carbonica e la riduzione elettrochimica dell’anidride carbonica.
Ciascuno di questi metodi presenta vantaggi e svantaggi e la scelta del metodo dipende da fattori quali disponibilità di materie prime, costi ed efficacia. La fermentazione rimane il metodo più utilizzato per la produzione di etanolo grazie alla sua efficienza in termini di costi e affidabilità.
Usi dell’etanolo
L’etanolo ha una vasta gamma di usi industriali, commerciali e personali. Alcuni dei suoi usi comuni includono:
- L’etanolo aumenta i livelli di ottano e riduce le emissioni se utilizzato come additivo per la benzina.
- L’etanolo è un solvente versatile comunemente utilizzato nella produzione di prodotti farmaceutici, cosmetici e per la cura personale.
- Le bevande alcoliche come birra, vino e liquori contengono etanolo come principio attivo.
- I disinfettanti per le mani, i detergenti per superfici e altri prodotti per la pulizia utilizzano l’etanolo come disinfettante efficace.
- L’etanolo viene utilizzato come solvente nell’estrazione di oli essenziali, aromi e altri composti naturali.
- I produttori utilizzano l’etanolo come materia prima per la produzione di altri prodotti chimici, come l’acido acetico e l’etilene.
- I prodotti per la cura personale come profumi, lozioni e prodotti per la cura dei capelli utilizzano l’etanolo come conservante e ingrediente profumante.
- I laboratori chimici usano comunemente l’etanolo come solvente e reagente.
- I sistemi automobilistici e altri sistemi di raffreddamento possono utilizzare l’etanolo come agente antigelo.
Domande:
Quanti atomi compongono una molecola di etanolo (C2H6O)?
Una molecola di etanolo (C2H6O) è composta da 9 atomi: 2 atomi di carbonio, 6 atomi di idrogeno e 1 atomo di ossigeno.
