Il butano (C₄H₁₀) è un gas idrocarburico altamente infiammabile. È comunemente usato come combustibile per accendini e fornelli da campo grazie alle sue efficienti proprietà di combustione e portabilità.
| Nome IUPAC | Butano |
| Formula molecolare | C₄H₁₀ |
| numero CAS | 106-97-8 |
| Sinonimi | n-butano, butil idruro, metiletilmetano, dietil |
| InChI | InChI=1S/C4H10/c1-3-4-2/h3-4H2.1-2H3 |
Proprietà del butano
Formula del butano
La formula del butano è C₄H₁₀, che indica che è composto da quattro atomi di carbonio e dieci atomi di idrogeno. La formula fornisce preziose informazioni sulla composizione chimica del butano, consentendo agli scienziati di studiarne le proprietà e il comportamento.
Massa molare del butano
La massa molare dell’idruro di butile può essere calcolata sommando le masse atomiche dei suoi elementi costitutivi. Per l’idruro di butile (C₄H₁₀), la massa molare è di circa 58,12 grammi per mole. La massa molare è un parametro cruciale in vari calcoli chimici e svolge un ruolo importante nel determinare le proprietà fisiche e chimiche dell’idruro di butile.
Punto di ebollizione del butano
L’idruro di butile ha un punto di ebollizione relativamente basso di circa -1°C (30°F). Ciò significa che a questa temperatura o al di sopra, l’idruro di butile passa facilmente dalla fase liquida a quella gassosa. Il basso punto di ebollizione rende l’idruro di butile un combustibile ideale per applicazioni quali accendini e fornelli da campo portatili.
Punto di fusione del butano
Il punto di fusione dell’idruro di butile è di circa -138,4°C (-217,12°F). A o al di sotto di questa temperatura, l’idruro di butile solido subisce un cambiamento di fase e diventa un liquido. Tuttavia, in condizioni atmosferiche normali, l’idruro di butile si incontra comunemente nella sua forma gassosa.
Densità del butano g/ml
La densità dell’idruro di butile è di circa 2,48 grammi per millilitro. Ciò indica che l’idruro di butile è più leggero dell’acqua, che ha una densità di 1 g/mL. La densità dell’idruro di butile è una proprietà cruciale che determina il suo comportamento durante lo stoccaggio o il trasporto, nonché le sue caratteristiche di combustione.
Peso molecolare del butano
Il peso molecolare dell’idruro di butile è di circa 58,12 grammi per mole. Rappresenta la somma dei pesi atomici di tutti gli atomi in una singola molecola di idruro di butile. Il peso molecolare è un parametro essenziale per vari calcoli scientifici e aiuta a comprendere le proprietà e il comportamento dell’idruro di butile.
Struttura del butano
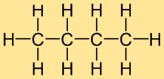
La struttura dell’idruro di butile è costituita da una catena lineare di quattro atomi di carbonio, a cui sono attaccati dieci atomi di idrogeno. Gli atomi di carbonio sono disposti in una linea continua e ciascun atomo di carbonio forma legami singoli con due atomi di carbonio vicini e tre atomi di idrogeno. Questa struttura lineare contribuisce alle proprietà fisiche e chimiche dell’idruro di butile.
Solubilità del butano
L’idruro di butile è considerato relativamente insolubile in acqua. Presenta una bassa solubilità a causa della sua natura non polare e delle deboli interazioni intermolecolari con le molecole d’acqua. Tuttavia, l’idruro di butile è altamente solubile in solventi organici come etanolo e acetone. Questo comportamento di solubilità è importante in varie applicazioni, come i processi di estrazione e le reazioni a base di solventi.
| Aspetto | Gas incolore |
| Peso specifico | 2.48 |
| Colore | N / A |
| Odore | Inodore |
| Massa molare | 58,12 g/mole |
| Densità | 2,48 g/ml |
| Punto di fusione | -138,4°C (-217,12°F) |
| Punto di ebollizione | -1°C (30°F) |
| Punto flash | -60°C (-76°F) |
| solubilità in acqua | Insolubile |
| Solubilità | Solubile in solventi organici |
| Pressione del vapore | 2,4 ATM a 20°C |
| Densità del vapore | 2.07 (aria = 1) |
| pKa | N / A |
| pH | N / A |
Sicurezza e pericoli del butano
L’idruro di butile presenta alcuni rischi per la sicurezza che devono essere considerati. È un gas altamente infiammabile e può facilmente accendersi in presenza di una fonte di accensione. È necessario prendere precauzioni per evitare incendi o esplosioni accidentali. È importante conservare e maneggiare l’idruro di butile in aree ben ventilate per evitare l’accumulo di vapori infiammabili. L’inalazione diretta di idruro di butile può essere dannosa perché sposta l’ossigeno e può causare asfissia. Inoltre, l’esposizione ad alte concentrazioni di idruro di butile può causare vertigini, sonnolenza e nausea. È essenziale seguire le opportune precauzioni di sicurezza, come l’utilizzo dell’idruro di butile in apparecchiature adeguatamente progettate e approvate ed evitare il contatto con fiamme libere o scintille.
| Simboli di pericolo | Gas infiammabile |
| Descrizione della sicurezza | Tenere lontano da fiamme libere e scintille. Conservare in un’area ben ventilata. Evitare l’inalazione e il contatto diretto. |
| Identificatori delle Nazioni Unite | ONU 1011 |
| Codice SA | 2711.12.20 |
| Classe di pericolo | Classe 2.1 (Gas infiammabile) |
| Gruppo di imballaggio | Gruppo di imballaggio II |
| Tossicità | L’idruro di butile è generalmente considerato a bassa tossicità. Tuttavia, l’inalazione di elevate concentrazioni può provocare vertigini, sonnolenza e nausea. Può anche spostare l’ossigeno negli spazi chiusi, provocando asfissia. Per garantire la sicurezza è necessario seguire procedure di ventilazione e manipolazione adeguate. |
Metodi di sintesi del butano
Vari metodi sintetizzano l’idruro di butile, coinvolgendo principalmente la produzione di petrolio o gas naturale.
Distillazione frazionata: durante la distillazione frazionata del petrolio greggio o del petrolio, il processo produce idruro di butile come sottoprodotto. Il processo di raffinazione separa diverse frazioni idrocarburiche in base al loro punto di ebollizione e l’idruro di butile è uno dei componenti che possono essere isolati.
Lavorazione del gas naturale: La lavorazione del gas naturale produce anche idruro di butile. Il gas naturale contiene vari idrocarburi, tra cui metano e idrocarburi superiori come l’idruro di butile. La miscela di gas naturale subisce processi come l’assorbimento o la separazione criogenica per separare l’idruro di butile.
Cracking degli idrocarburi: il processo di cracking rompe le catene di idrocarburi più grandi in catene più piccole, producendo idruro di butile. Ciò comporta il sottoporre gli idrocarburi più pesanti a temperature elevate o l’utilizzo di catalizzatori per generare idruro di butile come prodotto.
Isomerizzazione: L’isomerizzazione riorganizza la struttura molecolare degli idrocarburi, consentendo la sintesi dell’idruro di butile isomerizzando altri idrocarburi come pentano o esano nei suoi isomeri. Catalizzatori specifici catalizzano questo processo in condizioni appropriate.
Processo di sintesi: in laboratorio, gli scienziati possono sintetizzare l’idruro di butile attraverso vie sintetiche. Possono utilizzare varie reazioni chimiche, come l’idrogenazione o la riduzione, per produrre idruro di butile da composti precursori.
Questi metodi consentono di produrre idruro di butile in processi industriali su larga scala così come in laboratori su scala ridotta. La scelta del metodo dipende dalla disponibilità delle materie prime, dalla purezza desiderata e dai requisiti specifici dell’applicazione.
Usi del butano
L’idruro di butile trova applicazione in vari settori e nell’uso quotidiano grazie alle sue proprietà benefiche. Ecco alcuni usi comuni dell’idruro di butile:
- Carburante: l’idruro di butile alimenta fornelli portatili, stufe da campo e accendini come combustibile, grazie al suo alto contenuto energetico e alle efficienti proprietà di combustione.
- Propellente aerosol: l’idruro di butile spinge prodotti aerosol come spray per capelli, deodoranti per ambienti e vernici aerosol, consentendo loro di essere rilasciati sotto forma di nebbia sottile o spray.
- Refrigerante: l’idruro di butile raffredda e mantiene basse temperature nei sistemi di refrigerazione su piccola scala come frigoriferi e congelatori domestici, fungendo da refrigerante.
- Fluido per accendini: l’idruro di butile alimenta accendini e accendini a torcia, generando una fiamma che è un componente chiave dei fluidi per accendini.
- Estrazione: l’idruro di butile agisce come solvente nell’estrazione di oli essenziali e composti vegetali da materiali botanici, dissolvendo efficacemente i composti desiderati.
- Uso in laboratorio: i laboratori utilizzano l’idruro di butile come combustibile per i bruciatori Bunsen e la gascromatografia.
- Gas di calibrazione: l’idruro di butile funge da gas di calibrazione per rilevatori e sensori di gas, fornendo proprietà ben definite e facilmente misurabili.
- Saldatura e brasatura: le torce all’idruro di butile facilitano le operazioni di saldatura e brasatura grazie alle alte temperature, alla precisione e alla facilità d’uso.
- Attività ricreative: l’idruro di butile alimenta fornelli da campo portatili e torce elettriche, migliorando le attività ricreative all’aperto come il campeggio, l’escursionismo e la cucina.
- Fonte di consumo: l’idruro di butile funge da fonte di calore in una varietà di applicazioni, inclusi strumenti di riscaldamento, piccoli riscaldatori e applicazioni a fiamma in settori specifici.
La natura versatile dell’idruro di butile e la sua gamma di applicazioni lo rendono un composto prezioso in diversi settori, articoli per la casa e attività ricreative.
Domanda:
D: Dove posso acquistare gas butano vicino a me?
R: Di solito puoi trovare il gas idruro di butile nei negozi di ferramenta locali, nei supermercati o nei minimarket che vendono forniture da campeggio.
D: Il gas butano è gas naturale?
R: No, l’idruro di butile non è considerato gas naturale. È un gas idrocarburico derivato dalla lavorazione del petrolio o del gas naturale.
D: Cos’è il butano?
R: L’idruro di butile è un idrocarburo gassoso con la formula chimica C₄H₁₀. È un gas infiammabile incolore e inodore comunemente utilizzato come combustibile e in varie applicazioni.
D: Come viene prodotto il butano?
R: L’idruro di butile viene prodotto principalmente mediante processi quali la distillazione frazionata del petrolio o del gas naturale, il cracking di idrocarburi più pesanti o l’isomerizzazione di altri idrocarburi.
D: Come posso ricaricare un accendino a butano?
R: Per riempire un accendino all’idruro di butile, individua innanzitutto la valvola di ricarica, solitamente nella parte inferiore. Inserire l’ugello dell’idruro di butile nella valvola e premere con decisione per rilasciare l’idruro di butile nel lume fino a riempirlo.
D: Quale dei seguenti composti è un isomero strutturale del butano?
R: Il pentano (C₅H₁₂) è un isomero strutturale dell’idruro di butile, poiché entrambi i composti contengono quattro atomi di carbonio ma hanno disposizioni diverse.
D: Come posso ricaricare un accendino a butano?
R: Per ricaricare un accendino all’idruro di butile, tenere l’accendino capovolto, allineare l’ugello della cartuccia di ricarica dell’idruro di butile con la valvola di ricarica dell’accendino e premere con decisione sulla cartuccia per rilasciare l’idruro dal butile nell’accendino.
D: Dove posso acquistare butano vicino a me?
R: Puoi acquistare l’idruro di butile nei negozi di ferramenta locali, nei supermercati o nei minimarket che vendono forniture da campeggio o articoli per la casa.
D: Dove acquistare butano?
R: L’idruro di butile può essere acquistato da una varietà di fonti, inclusi rivenditori online, negozi di ferramenta, negozi di forniture per campeggio e alcuni supermercati.
D: Quale affermazione confronta meglio il punto di fusione del butano (C₄H₁₀) con quello dell’ottano (C₈H₁₈)?
R: L’ottano, con una struttura molecolare più grande e complessa, generalmente ha un punto di fusione più elevato rispetto all’idruro di butile.
D: Qual è la massa molare del butano, C₄H₁₀?
R: La massa molare dell’idruro di butile (C₄H₁₀) è di circa 58,12 grammi per mole.
D: Quanti isomeri sono possibili per C₄H₁₀?
R: L’idruro di butile (C₄H₁₀) ha due isomeri: n-butano (butano normale) e isobutano (2-metilpropano).
D: Quale dei composti C₄H₁₀, SrCl₂, Cr(NO₃)₃, OF₂ dovrebbe esistere come molecole?
R: Si prevede che C₄H₁₀ (idruro di butile) e OF₂ (difluoruro di ossigeno) esistano come molecole, mentre SrCl₂ e Cr(NO₃)₃ sono composti ionici.
