Il bromuro di magnesio (MgBr2) è un composto composto da Mg e Br. È comunemente usato come catalizzatore nelle reazioni di sintesi organica e come sedativo in medicina.
| Nome IUPAC | Bromuro di magnesio |
| Formula molecolare | MgBr2 |
| numero CAS | 7789-48-2 |
| Sinonimi | Dibromuro di magnesio, UN1913, Bromomagnesite, Bromato di magnesio, Magnesiumbromid, Bromuro di magnesio |
| InChI | InChI=1S/2BrH.Mg/h2*1H;/q;;+2/p-2 |
Proprietà del bromuro di magnesio
Formula di bromuro di magnesio
La formula chimica del bromuro di magnesio è MgBr2. Ciò indica che MgBr2 è composto da uno ione Mg+2 e due ioni Br-. La formula rappresenta il rapporto tra gli atomi in una molecola e svolge un ruolo fondamentale nel determinare le proprietà di un composto. La formula del bromuro di magnesio indica che si tratta di un composto ionico con un elevato punto di fusione e di ebollizione e un forte legame ionico tra Mg+2 e Bri-ioni.
Massa molare del bromuro di magnesio
La massa molare di MgBr2 è 184,113 g/mol. È la somma delle masse atomiche del magnesio e di due atomi di bromo. La massa molare è un parametro cruciale nei calcoli chimici perché aiuta a determinare il numero di moli di una sostanza in una determinata quantità di campione. La massa molare di MgBr2 svolge un ruolo fondamentale nel determinare la quantità di composto necessaria per le reazioni chimiche.
Punto di ebollizione del bromuro di magnesio
MgBr2 ha un punto di ebollizione di 1.204 gradi Celsius o 2.199 gradi Fahrenheit. Il punto di ebollizione di un composto è la temperatura alla quale la sua pressione di vapore eguaglia la pressione atmosferica. L’alto punto di ebollizione di MgBr2 indica che si tratta di un composto stabile in grado di resistere alle alte temperature senza decomposizione. Questa caratteristica lo rende utile in applicazioni ad alta temperatura come la metallurgia e le reazioni di sintesi organica.
Punto di fusione del bromuro di magnesio
MgBr2 ha un punto di fusione di 714 gradi Celsius o 1.317 gradi Fahrenheit. Il punto di fusione di un composto è la temperatura alla quale passa dallo stato solido a quello liquido. L’alto punto di fusione di MgBr2 indica che si tratta di un composto stabile con forti forze intermolecolari. Questa caratteristica lo rende utile come reagente nelle reazioni chimiche ad alte temperature.
Densità del bromuro di magnesio g/mL
La densità di MgBr2 è 3,72 g/mL. La densità è una misura della quantità di massa per unità di volume di una sostanza. L’elevata densità di MgBr2 indica che si tratta di un composto pesante che può affondare nell’acqua. Questa caratteristica lo rende utile in diverse applicazioni come la sintesi inorganica e come sedativo in medicina.
Peso molecolare del bromuro di magnesio
Il peso molecolare di MgBr2 è 184,113 g/mol. È la somma delle masse atomiche del magnesio e di due atomi di bromo. Il peso molecolare gioca un ruolo cruciale nel determinare le proprietà chimiche e fisiche di un composto. Il peso molecolare di MgBr2 influenza la sua reattività e solubilità in vari solventi.
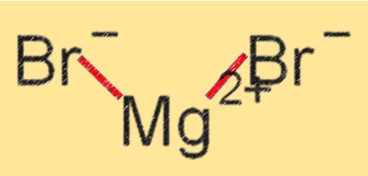
Struttura del bromuro di magnesio
MgBr2 ha una struttura reticolare cristallina con gli ioni Mg+2 e Br- tenuti insieme da legami ionici. È un solido cristallino bianco altamente solubile in acqua e altri solventi polari. La struttura reticolare cristallina di MgBr2 contribuisce ai suoi elevati punti di fusione e ebollizione, nonché alla sua stabilità in varie reazioni chimiche.
| Aspetto | Solido cristallino bianco |
| Peso specifico | 3,72 g/ml |
| Colore | Bianco |
| Odore | Inodore |
| Massa molare | 184.113 g/mole |
| Densità | 3,72 g/ml |
| Punto di fusione | 714°C (1.317°F) |
| Punto di ebollizione | 1204°C (2199°F) |
| Punto flash | Non applicabile |
| solubilità in acqua | Molto solubile |
| Solubilità | Solubile in acqua, etanolo, acetone ed etere |
| Pressione del vapore | Non applicabile |
| Densità del vapore | Non applicabile |
| pKa | Non applicabile |
| pH | Neutro |
Sicurezza e pericoli del bromuro di magnesio
MgBr2 è generalmente considerato sicuro se maneggiato correttamente. Tuttavia, come qualsiasi composto chimico, può rappresentare un pericolo se non maneggiato con attenzione. MgBr2 è corrosivo e può causare gravi irritazioni alla pelle e agli occhi. L’inalazione di polvere o fumi di MgBr2 può causare irritazione respiratoria. È importante indossare indumenti protettivi e apparecchiature respiratorie durante la manipolazione di MgBr2. MgBr2 può anche reagire violentemente con alcune sostanze chimiche, come acqua o acidi, producendo gas di acido bromidrico. Pertanto, è fondamentale conservare e maneggiare MgBr2 lontano da sostanze incompatibili e in un’area ben ventilata.
| Simboli di pericolo | Corrosivo |
| Descrizione della sicurezza | Evitare il contatto con la pelle e gli occhi. Indossare indumenti protettivi e apparecchiature respiratorie. Maneggiare e conservare lontano da sostanze incompatibili. |
| Numeri di identificazione delle Nazioni Unite | UN2920 |
| Codice SA | 2827.59.90 |
| Classe di pericolo | 8 |
| Gruppo di imballaggio | II |
| Tossicità | Bassa tossicità se maneggiato correttamente. Può causare irritazione alla pelle e agli occhi. L’inalazione di polvere o fumi può causare irritazione respiratoria. |
Metodi per la sintesi del bromuro di magnesio
MgBr2 può essere sintetizzato con diversi metodi.
Un metodo comune è la reazione tra magnesio metallico e gas di acido bromidrico . Questo processo prevede il passaggio del gas bromuro di idrogeno sul metallo Mg, producendo MgBr2 e gas idrogeno.
Un altro metodo è la reazione tra ossido di magnesio o idrossido di magnesio e acido bromidrico . Questo processo produce MgBr2 e acqua come prodotti.
Inoltre, MgBr2 può essere sintetizzato dalla reazione tra carbonato di magnesio e acido bromidrico o dalla reazione tra solfato di magnesio e NaBr.
Questi metodi prevedono la miscelazione dei reagenti e il proseguimento della reazione, con conseguente formazione di MgBr2.
Usi del bromuro di magnesio
MgBr2 ha vari usi in vari settori. Ecco alcune delle sue applicazioni comuni:
- Nella sintesi organica: utilizzato come catalizzatore dell’acido di Lewis nelle reazioni di sintesi organica, come la reazione di Grignard, che comporta la formazione di legami carbonio-carbonio.
- Nella produzione di ritardanti di fiamma: i ritardanti di fiamma, che rendono i materiali meno infiammabili, ne fanno affidamento come componente cruciale nella loro produzione.
- Nell’industria petrolifera e del gas: utilizzato come fluido di completamento nei pozzi di petrolio e gas, che aiuta a mantenere la pressione e previene il collasso dei pozzi.
- In campo farmaceutico: utilizzato come principio attivo in alcuni prodotti farmaceutici, come sedativi e anticonvulsivanti.
- In elettrochimica: utilizzato come elettrolita nelle batterie e in altri dispositivi elettrochimici.
- Nella produzione di metalli: utilizzato come flusso nella produzione di alcuni metalli, come alluminio e titanio.
- In chimica analitica: utilizzato come reagente in chimica analitica per la determinazione di vari elementi, come boro e fluoruro.
Domande:
D: Qual è la formula chimica del bromuro di magnesio?
R: La formula chimica del bromuro di magnesio è MgBr2.
D: Il bromuro di magnesio è ionico o covalente?
R: MgBr2 è un composto ionico.
D: Qual è la formula del bromuro di magnesio?
R: La formula del bromuro di magnesio è MgBr2.
D: Il bromuro di magnesio è solubile in acqua?
R: Sì, MgBr2 è solubile in acqua. È molto solubile in acqua e può dissolversi per formare una soluzione limpida e incolore.
D: Qual è la formula del bromuro di magnesio?
R: La formula del bromuro di magnesio è MgBr2.
