Il boroidruro di sodio (NaBH4) è una polvere cristallina bianca utilizzata come agente riducente nella sintesi organica e come fonte di idrogeno per le celle a combustibile. È molto reattivo e sensibile all’acqua.
| Nome IUPAC | Tetraidroborato di sodio |
| Formula molecolare | NaBH4 |
| numero CAS | 16940-66-2 |
| Sinonimi | Boroidruro di sodio, tetraidroborato di sodio, boroidruro di sodio idrato, tetraidroborato di sodio idrato |
| InChI | InChI=1S/BH4.Na/h1H4;/q+1;-1 |
Proprietà del boroidruro di sodio
Punto di ebollizione del boroidruro di sodio
Il boroidruro di sodio non ha un punto di ebollizione ben definito perché si decompone quando riscaldato. La temperatura di decomposizione dipende dalle condizioni di temperatura e pressione.
Punto di fusione del boroidruro di sodio
Il boroidruro di sodio ha un punto di fusione compreso tra 240 e 242°C. A questa temperatura, la forma solida di NaBH4 passa allo stato liquido.
Densità del boroidruro di sodio g/ml
La densità del boroidruro di sodio è 1,33 g/ml. È un solido cristallino bianco relativamente denso rispetto ad altre sostanze.
Massa molare del boroidruro di sodio
La massa molare del boroidruro di sodio (NaBH4) è 37,83 g/mol. Si calcola sommando le masse atomiche di tutti gli atomi presenti nella formula molecolare del NaBH4 (1 atomo di sodio, 1 atomo di boro e 4 atomi di idrogeno).
Peso molecolare del boroidruro di sodio
Il peso molecolare del boroidruro di sodio è 37,83 g/mol. Questa è la somma delle masse atomiche dei singoli atomi nella formula molecolare di NaBH4.
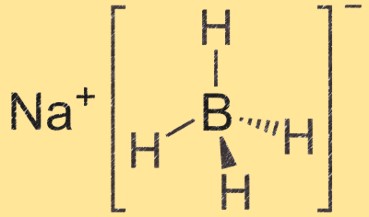
Struttura del boroidruro di sodio
Il boroidruro di sodio è una molecola tetraedrica con uno ione sodio al centro e quattro gruppi idruro di boro attaccati ad esso. L’atomo di boro è legato a quattro atomi di idrogeno, creando una struttura tetraedrica.
Formula di boroidruro di sodio
La formula chimica del tetraidroborato di sodio è NaBH4. È composto da un atomo di sodio (Na), un atomo di boro (B) e quattro atomi di idrogeno (H). Questa formula rappresenta la composizione chimica di questa sostanza e la sua composizione elementare.
| Aspetto | Polvere cristallina bianca |
| Peso specifico | 1,33 g/ml |
| Colore | Bianco |
| Odore | Inodore |
| Massa molare | 37,83 g/mole |
| Densità | 1,33 g/ml |
| Punto di fusione | 240-242°C |
| Punto di ebollizione | Si decompone per riscaldamento |
| Punto flash | Non applicabile |
| solubilità in acqua | Solubile in acqua |
| Solubilità | Solubile in solventi organici |
| Pressione del vapore | Non applicabile |
| Densità del vapore | Non applicabile |
| pKa | Non applicabile |
| pH | Non applicabile |
Sicurezza e pericoli del boroidruro di sodio
Il tetraidroborato di sodio è infiammabile e reattivo con l’acqua. Può rilasciare gas idrogeno infiammabile e formare miscele esplosive con l’aria. Il tetraidroborato di sodio è anche irritante per la pelle e gli occhi. È necessario utilizzare una ventilazione adeguata e dispositivi di protezione individuale per ridurre al minimo l’esposizione durante la manipolazione del tetraidroborato di sodio. Conservarlo in un luogo fresco e asciutto, lontano da fonti di calore e dall’acqua.
| Simboli di pericolo | Infiammabile, irritante |
| Descrizione della sicurezza | S26, S36/37 |
| Numeri di identificazione delle Nazioni Unite | UN3375 |
| Codice SA | 2827.90.90 |
| Classe di pericolo | 4.3 |
| Gruppo di imballaggio | II |
| Tossicità | Moderatamente tossico per ingestione, inalazione e contatto con la pelle |
Metodi per la sintesi del boroidruro di sodio
Il boroidruro di sodio (NaBH4) può essere sintetizzato con diversi metodi, tra cui:
- Riduzione del sodio metallico: questo metodo prevede la riduzione del triossido di boro (B2O3) con sodio metallico per produrre NaBH4.
- Riduzione dell’idruro di sodio: l’idruro di sodio (NaH) può essere utilizzato per ridurre i trialogenuri di boro per produrre NaBH4.
- Riduzione dell’idruro di litio e alluminio: l’idruro di litio e alluminio (LiAlH4) può essere utilizzato per ridurre gli alogenuri di boro per produrre NaBH4.
- Idrogenazione: Il boroidruro di sodio può essere sintetizzato mediante idrogenazione del boroidruro di sodio (NaBH3H).
Tutti questi metodi dovrebbero essere eseguiti con attrezzature specializzate e personale addestrato in un ambiente ben ventilato perché il tetraidroborato di sodio è infiammabile e reattivo. Il metodo di sintesi selezionato dipenderà dalla resa desiderata, dalla purezza e da considerazioni sui costi.
Usi del boroidruro di sodio
Il tetraidroborato di sodio (NaBH4) è un agente riducente versatile e ha un’ampia gamma di applicazioni in vari campi. Alcuni degli usi comuni del tetraidroborato di sodio sono:
- Sintesi organica: NaBH4 viene utilizzato nella riduzione di composti carbonilici, esteri, nitrili e ammidi nei loro corrispondenti alcoli, aldeidi e ammine.
- Prodotti farmaceutici: il tetraidroborato di sodio viene utilizzato nella sintesi di vari ingredienti farmaceutici attivi e nella preparazione di composti chirali.
- Scienza dei polimeri: NaBH4 è utilizzato nella riduzione delle resine epossidiche e delle resine poliestere insature.
- Ambiente: il tetraidroborato di sodio può essere utilizzato nel trattamento delle acque reflue per ridurre gli inquinanti come metalli pesanti e coloranti.
- Industria alimentare: NaBH4 è utilizzato come agente riducente nella produzione di creme spalmabili, gelati e cioccolato a basso contenuto di grassi.
Nel complesso, il tetraidroborato di sodio ha dimostrato di essere uno strumento prezioso nel campo della sintesi chimica grazie alle sue blande proprietà riducenti e alla sua capacità di ridurre selettivamente gruppi funzionali in strutture molecolari complesse.
Domande:
Quale di questi composti può essere ridotto dal boroidruro di sodio? controlla tutte le applicazioni.
Il tetraidroborato di sodio (NaBH4) può ridurre un’ampia gamma di composti, tra cui:
- Composti carbonilici, come aldeidi e chetoni
- Nitrili
- Esteri
- Ammidi
- Resine epossidiche
- Resine poliestere insature
- Alcuni coloranti
- Metalli pesanti
- Composti chirali
È importante notare che condizioni e parametri di reazione specifici possono influenzare l’efficienza di riduzione e la selettività del processo di riduzione. Inoltre, non tutti i composti sono adatti alla riduzione con tetraidroborato di sodio, poiché alcuni possono subire reazioni collaterali indesiderate.
Perché è importante esporre il boroidruro di sodio all’umidità?
L’esposizione del tetraidroborato di sodio (NaBH4) all’umidità è importante per diversi motivi:
- Reattività: il tetraidroborato di sodio è molto reattivo e può decomporsi rapidamente in presenza di umidità, generando gas idrogeno e calore. Ciò può comportare il rischio di esplosione e incendio se non gestito correttamente.
- Idrolisi: il tetraidroborato di sodio si idrolizza facilmente in presenza di umidità per formare tetraidroborato di sodio idrato (NaBH4.xH2O), che ha proprietà riducenti ridotte rispetto alla forma anidra.
- Stabilità di conservazione: l’umidità può causare la decomposizione graduale del tetraidroborato di sodio, riducendone la durata di conservazione e l’efficacia come agente riducente.
Pertanto, è importante conservare il boroidruro di sodio in un contenitore asciutto e ermetico e maneggiarlo in un ambiente ben ventilato per ridurre al minimo l’esposizione all’umidità. Se l’esposizione all’umidità è inevitabile, l’uso di agenti che eliminano l’umidità o di atmosfere protettive può aiutare a minimizzarne gli effetti sulla stabilità e sulla reattività del tetraidroborato di sodio.
Il boroidruro di sodio è un catalizzatore?
Il tetraidroborato di sodio (NaBH4) non è generalmente considerato un catalizzatore, ma piuttosto un agente riducente. Un catalizzatore è una sostanza che accelera una reazione chimica senza subire cambiamenti permanenti. Il tetraidroborato di sodio cambia chimicamente man mano che viene ridotto, consumandosi nella reazione di riduzione.
Le reazioni di sintesi e riduzione organica utilizzano comunemente il tetraidroborato di sodio come fonte di ioni idruro (H-). Il tetraidroborato di sodio trasferisce questi ioni idruro alla molecola del substrato, riducendo così i gruppi funzionali come carbonili, nitrili ed esteri. Nonostante il suo ruolo di agente riducente, il tetraidroborato di sodio può svolgere un ruolo secondario come accettore di protoni, rendendolo una base debole che può influenzare le condizioni di reazione e influenzarne l’esito.
Quale gas infiammabile viene prodotto se il boroidruro di sodio viene miscelato con acqua?
Se il tetraidroborato di sodio (NaBH4) viene miscelato con acqua, subisce una rapida idrolisi per formare boroidruro di sodio idrato (NaBH4.xH2O) e gas idrogeno. Il gas idrogeno prodotto è infiammabile e può presentare pericolo di esplosione e incendio se non maneggiato correttamente.
La reazione tra tetraidroborato di sodio e acqua può essere esotermica e generare calore, che può accelerare ulteriormente la velocità di idrolisi e aumentare il rilascio di gas idrogeno. La reazione può anche generare un grande volume di gas in breve tempo, creando il rischio di sovrapressione ed esplosione.
Pertanto, è importante maneggiare il tetraidroborato di sodio in un ambiente ben ventilato ed evitare di esporlo all’umidità o all’acqua. Se l’esposizione all’umidità è inevitabile, l’uso di agenti che eliminano l’umidità o di atmosfere protettive può aiutare a ridurre al minimo la velocità di idrolisi e il rilascio di gas idrogeno.
Quante moli di canfora reagiscono con il boroidruro di sodio?
Il numero di moli di canfora che reagiscono con il tetraidroborato di sodio (NaBH4) dipende da diversi fattori, tra cui la stechiometria della reazione, la concentrazione e la purezza dei reagenti e le condizioni di reazione. La stechiometria della reazione può essere determinata dall’equazione chimica per la riduzione della canfora in isoborneolo utilizzando tetraidroborato di sodio:
C10H16O + 4 NaBH4 → C10H18O + 4 NaBO2 + 4 H2
Secondo l’equazione, una mole di canfora reagisce con 4 moli di tetraidroborato di sodio. La quantità effettiva di canfora che reagirà con una determinata quantità di NaBH4 dipenderà dalla concentrazione e dalla purezza dei reagenti, nonché dalle condizioni di reazione come temperatura, tempo e catalizzatore.
Pertanto, senza informazioni più precise, non è possibile determinare il numero esatto di moli di canfora che reagiranno con il tetraidroborato di sodio.
