Il borato di sodio è un composto utilizzato in vari settori. Ha molteplici applicazioni, come agente detergente, fondente nella metallurgia e componente in cosmetici e detergenti.
| Nome IUPAC | Borato di sodio |
| Formula molecolare | Na2B4O7 |
| numero CAS | 1330-96-4 |
| Sinonimi | Borace, tetraborato di sodio, tetraborato disodico, biborato di sodio |
| InChI | InChI=1S/B4O7.2Na/c5-1-7-3-9-2-8-4-10-3;;/q-2;2*+1 |
Proprietà del borato di sodio
Formula del borato di sodio
La formula chimica del borato di sodio è Na2B4H20O17. È costituito da due atomi di sodio (Na), quattro atomi di boro (B) e sette atomi di ossigeno (O). La formula rappresenta il rapporto di ciascun elemento nel composto.
Massa molare del borato di sodio
La massa molare del borace si calcola sommando le masse atomiche di tutti gli atomi presenti nel composto. La massa molare del borace è di circa 381,37 grammi per mole (g/mol). È utile per determinare la quantità di sostanza presente in un dato campione.
Punto di ebollizione del borato di sodio
Il borace ha un punto di ebollizione relativamente alto. Alla pressione atmosferica standard, bolle a circa 1.575 gradi Celsius (C). Questo alto punto di ebollizione lo rende adatto a varie applicazioni industriali che coinvolgono processi ad alta temperatura.
Borato di sodio Punto di fusione
Il borace ha un punto di fusione di circa 741 gradi Celsius (C). A questa temperatura subisce una transizione di fase dallo stato solido a quello liquido. Il punto di fusione relativamente basso consente al borace di sciogliersi facilmente e di essere utilizzato in vari processi produttivi.
Densità del borato di sodio g/ml
La densità del borace è di circa 1,73 grammi per millilitro (g/mL). La densità è una misura della quantità di massa contenuta in un dato volume. La densità relativamente elevata del borace lo rende un composto utile in applicazioni in cui il suo peso o la sua concentrazione sono importanti.
Peso molecolare del borato di sodio
Il peso molecolare del borace è di circa 381,37 grammi per mole (g/mol). Rappresenta la somma dei pesi atomici di tutti gli atomi in una molecola di borace. Il peso molecolare è essenziale per vari calcoli, come determinare il numero di moli o la massa di una sostanza.
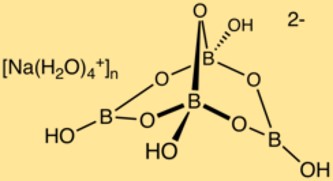
Struttura del borato di sodio
Il borace ha una struttura cristallina complessa composta da poliedri boro-ossigeno e ioni sodio. Gli atomi di boro formano una rete con gli atomi di ossigeno, creando una struttura tridimensionale. Gli ioni sodio si trovano in questa struttura, garantendo la stabilità del composto.
Solubilità del borato di sodio
Il borace è moderatamente solubile in acqua. Si scioglie facilmente in acqua calda e la sua solubilità aumenta con la temperatura. Tuttavia la sua solubilità nei solventi organici è limitata. La solubilità del borace lo rende utile per una varietà di applicazioni, incluso come agente detergente e nella formulazione di soluzioni e miscele.
| Aspetto | Polvere cristallina bianca |
| Peso specifico | 1,73 g/ml |
| Colore | Bianco |
| Odore | Inodore |
| Massa molare | 381,37 g/mole |
| Densità | 1,73 g/ml |
| Punto di fusione | 741°C |
| Punto di ebollizione | 1575°C |
| Punto flash | Non applicabile |
| solubilità in acqua | Solubile |
| Solubilità | Solubile in acqua, solubilità limitata nei solventi organici |
| Pressione del vapore | Non disponibile |
| Densità del vapore | Non disponibile |
| pKa | Non applicabile |
| pH | Intorno alle 9:00-10:00 |
Sicurezza e pericoli del borato di sodio
Il borace deve essere maneggiato con cautela a causa dei suoi potenziali rischi per la sicurezza. Può causare irritazione alla pelle, agli occhi e al sistema respiratorio per contatto diretto o inalazione. L’ingestione di grandi quantità può causare disturbi gastrointestinali. Quando si lavora con il borace è necessario utilizzare misure protettive, come guanti e occhiali protettivi, per evitare l’esposizione. È importante conservarlo in un’area sicura e ben ventilata, lontano da sostanze incompatibili. In caso di ingestione o esposizione accidentale, è necessario consultare immediatamente un medico. Per informazioni dettagliate sui pericoli del borace e sulle precauzioni di sicurezza, consultare le appropriate schede tecniche sulla sicurezza dei materiali e le istruzioni per la manipolazione.
| Simboli di pericolo | Tossico |
| Descrizione della sicurezza | Nocivo se ingerito. Provoca irritazione alla pelle e agli occhi. |
| Numeri di identificazione delle Nazioni Unite | ONU 1458 |
| Codice SA | 2840.19.20 |
| Classe di pericolo | 6.1 (Sostanze tossiche) |
| Gruppo di imballaggio | III |
| Tossicità | Tossicità moderata per ingestione o contatto con la pelle/occhi. |
Metodi per la sintesi del borato di sodio
Esistono diversi metodi per sintetizzare il borace. Un metodo comune è la reazione tra borace (tetraborato di sodio decaidrato) e carbonato di sodio . In questo processo, sciogliere il borace in acqua e quindi aggiungere carbonato di sodio alla soluzione. La reazione avviene, formando borace e precipitando un solido. Separare ed essiccare il solido per ottenere il borace.
Un altro metodo consiste nel sciogliere l’acido borico in acqua e aggiungere gradualmente idrossido di sodio alla soluzione. La reazione avviene e forma borace. Far evaporare la soluzione per eliminare l’acqua in eccesso e ottenere cristalli di borace.
Inoltre, mescolare l’ossido di boro con l’idrossido di sodio in un solvente adatto e riscaldare la miscela. La reazione avviene e forma borace. Filtra la miscela per separare le impurità e lascia che il filtrato si raffreddi e cristallizzi, ottenendo borace.
Questi metodi sintetici forniscono percorsi per ottenere il borace in modo controllato. Tuttavia, è importante seguire adeguate precauzioni di sicurezza e gestire le sostanze chimiche in modo responsabile durante il processo di sintesi.
Usi del borato di sodio
Il borace, noto anche come borace, ha una vasta gamma di usi in vari settori grazie alle sue proprietà versatili. Ecco alcune delle sue applicazioni comuni:
- Flusso in metallurgia: serve come flusso nelle applicazioni di saldatura e brasatura, contribuendo a ridurre il punto di fusione dei metalli e facilitando il flusso del metallo fuso.
- Ritardante di fiamma: trova applicazione come ritardante di fiamma in vari materiali tra cui isolanti in cellulosa, tessuti e prodotti in legno.
- Vetro e ceramica: il borace è un componente essenziale nella produzione di vetro e ceramica. Aiuta ad abbassare il punto di fusione, a migliorare la durabilità e a migliorare le proprietà ottiche di questi materiali.
- Tampone pH: funziona come tampone pH nei laboratori e negli esperimenti scientifici.
- Detergente: prodotti per la casa come detersivi per bucato, detersivi per piatti e detergenti multiuso utilizzano efficacemente il borace come detergente.
- Cosmetici: i cosmetici e i prodotti per la cura personale utilizzano il borace come agente tampone, regolatore del pH ed emulsionante.
- Conservante: i prodotti in legno contengono borace come conservante per prevenire infestazioni di funghi e insetti.
- Agricoltura: il borace agisce come fertilizzante micronutriente per correggere le carenze di boro nelle colture, promuovendo così una crescita sana delle piante.
- Applicazioni mediche: le formulazioni medicinali incorporano borace per le sue proprietà antisettiche e astringenti.
- Trattamento dell’acqua: i processi di trattamento dell’acqua utilizzano borace per inibire la crescita delle alghe e controllare i livelli di pH.
Queste diverse applicazioni evidenziano l’importanza del borace in vari settori, rendendolo un composto prezioso e versatile.
Domande:
D: A cosa serve il borato di sodio?
R: Il borace viene utilizzato come detergente, fondente nella metallurgia, componente nei cosmetici, ritardante di fiamma, nella produzione di vetro/ceramica, come conservante del legno, ecc.
D: Dove acquistare borato di sodio?
R: Il borace può essere acquistato da vari fornitori di prodotti chimici, negozi di ferramenta, mercati online e alcuni negozi di alimentari.
D: Quale sarà il catione quando il borato di sodio si dissolve?
R: Il catione rilasciato quando il borace si dissolve è il sodio (Na+).
D: Il borato di sodio è uguale all’acido borico?
R: No, il borace e l’acido borico sono composti diversi, sebbene entrambi contengano boro.
D: Il borato di sodio è uguale al borace?
R: Sì, il borace è comunemente chiamato borace.
D: È a base di borato di sodio?
R: Il borace agisce come una base debole nelle soluzioni acquose.
D: Il borato di sodio è sicuro da bere?
R: Il borace non deve essere ingerito poiché può essere tossico. Non è destinato al consumo.
D: Il borato di sodio neutralizza l’acido solforico?
R: No, il borace non neutralizza l’acido solforico. Può reagire ma non lo neutralizzerà completamente.
D: Qual è la funzione del borato di sodio nel tampone di eluizione a pH 10?
R: Il borace nel tampone di eluizione a pH 10 facilita l’eluizione di biomolecole caricate negativamente dalle colonne cromatografiche.
D: Cos’è il borace?
R: Il borace, noto anche come borato di sodio, è un composto minerale presente in natura costituito da molecole di sodio, boro, ossigeno e acqua.
D: Cosa succede quando il borace viene riscaldato fortemente?
R: Quando il borace viene riscaldato fortemente, subisce disidratazione e perde le sue molecole d’acqua, con conseguente formazione di borace anidro.
D: Il borace è uguale all’acido borico?
R: No, il borace e l’acido borico sono composti diversi. Il borace è borato di sodio, mentre l’acido borico è una forma acida del boro.
D: Cos’è la polvere di borace?
R: La polvere di borace si riferisce alla forma in polvere del borace, che viene utilizzata per una varietà di scopi come la pulizia, il bucato e l’artigianato.
