Il bisolfito di potassio è un composto chimico. Ha la formula KHSO3. Agisce come conservante e antiossidante nel cibo e nel vino.
| Nome dell’IUPAC | Idrogeno solforato di potassio |
| Formula molecolare | KHSO3 |
| numero CAS | 7773-03-7 |
| Sinonimi | Bisolfito di potassio, bisolfito di potassio, sale monopotassico, solfito monopotassico, idrosolfito di potassio |
| InChI | InChI=1S/K.H2O3S/c;1-4(2)3/h;(H2,1,2,3)/q+1;/p-1 |
Proprietà del bisolfito di potassio
Formula di bisolfito di potassio
La formula del bisolfito di potassio è KHSO3. Questa formula mostra il rapporto tra atomi di potassio, idrogeno, zolfo e ossigeno in un’unità di bisolfito di potassio. La formula può anche essere scritta come KH(SO3), il che dimostra che il bisolfito di potassio è un sale di potassio e acido solforoso (H2SO3).
Massa molare del bisolfito di potassio
La massa molare del bisolfito di potassio è 120,1694 g/mol. Ciò significa che una mole di bisolfito di potassio ha una massa di 120,1694 grammi. La massa molare viene calcolata aggiungendo le masse atomiche di potassio, idrogeno, zolfo e ossigeno nella formula KHSO3.
Punto di ebollizione del bisolfito di potassio
KHSO3 non ha un punto di ebollizione definito perché si decompone prima di raggiungere il punto di ebollizione. Se riscaldato a temperature superiori a 190°C, KHSO3 si decompone in metabisolfito di potassio e acqua. La reazione di decomposizione è endotermica, ovvero assorbe calore dall’ambiente.
Punto di fusione del bisolfito di potassio
KHSO3 ha un punto di fusione di 190°C, la stessa temperatura alla quale si decompone. Pertanto, KHSO3 non esiste in forma liquida in condizioni normali. È un solido cristallino bianco che si dissolve in acqua.
Bisolfito di potassio Densità g/ml
La densità di KHSO3 è 2,103 g/ml a 20°C. Ciò significa che un millilitro di KHSO3 ha una massa di 2.103 grammi. La densità è influenzata dalla temperatura e dalla concentrazione della soluzione.
Peso molecolare del bisolfito di potassio
Il peso molecolare di KHSO3 è uguale alla sua massa molare, che è 120,1694 g/mol. Il peso molecolare è la massa di una molecola KHSO3, che è molto piccola e non può essere misurata direttamente. Il peso molecolare è utile per calcolare il numero di molecole in una data massa o volume di una sostanza.
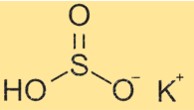
Struttura del bisolfito di potassio
KHSO3 ha una struttura composta da ioni K+ e HSO3-. Lo ione bisolfito ha una forma tetraedrica con un atomo di idrogeno e tre atomi di ossigeno legati ad un atomo di zolfo centrale. L’atomo di zolfo ha un doppio legame con un atomo di ossigeno e un legame singolo con gli altri due atomi di ossigeno. L’atomo di idrogeno è attaccato a uno degli atomi di ossigeno legati singolarmente.
Solubilità del bisolfito di potassio
KHSO3 è una miscela chimica che si dissolve in acqua per formare ioni potassio e ioni bisolfito. Ha un odore solforoso e un aspetto solido bianco. È solubile in acqua, con una solubilità di 49 g/100 mL a 20°C. Viene utilizzato come agente sterilizzante nella produzione di bevande alcoliche.
| Aspetto | Polvere cristallina bianca |
| Densità specifica | 2.103 |
| Colore | Bianco |
| Odore | tipica SO2 |
| Massa molare | 120,1694 g/mole |
| Densità | 2.103 g/ml a 20°C |
| Punto di fusione | 190°C (si decompone) |
| Punto di ebollizione | N/A (scomposto) |
| Punto flash | N / A |
| solubilità in acqua | 49 g/100 ml a 20°C |
| Solubilità | Insolubile in alcool |
| Pressione del vapore | N / A |
| Densità del vapore | N / A |
| pKa | 6,97 a 25°C |
| pH | 4,5 (soluzione 0,1 milioni) |
Sicurezza e pericoli del bisolfito di potassio
KHSO3 è una sostanza corrosiva che può causare gravi ustioni alla pelle e danni agli occhi. Può anche causare irritazione delle vie respiratorie e ustioni del tratto digestivo se inalato o ingerito. È sensibile all’umidità e rilascia anidride solforosa tossica quando reagisce con gli acidi. Deve essere maneggiato con cura e con adeguati dispositivi di protezione individuale. Dovrebbe essere conservato in un’area asciutta e ben ventilata, lontano da fonti di calore, scintille, fiamme e materiali incompatibili. Deve essere smaltito secondo le normative locali. In caso di esposizione consultare immediatamente un medico e seguire le misure di primo soccorso indicate sulla scheda di sicurezza.
| Simboli di pericolo | C (corrosivo) |
| Descrizione della sicurezza | S26: In caso di contatto con gli occhi, lavare immediatamente e abbondantemente con acqua e consultare un medico. S36/37/39: Indossare indumenti protettivi, guanti e proteggersi gli occhi/il viso adeguati. S45: In caso di incidente o di malessere consultare immediatamente il medico (se possibile, mostrargli l’etichetta). |
| Numeri di identificazione delle Nazioni Unite | ONU 3260 |
| Codice SA | 2832 10 00 |
| Classe di pericolo | 8 |
| Gruppo di imballaggio | II |
| Tossicità | LD50 orale (ratto): 2340 mg/kg |
Metodi di sintesi del bisolfito di potassio
Ecco alcuni metodi per sintetizzare KHSO3:
- Un metodo prevede la reazione con anidride solforosa e carbonato di potassio in una soluzione. Per ottenere cristalli di KHSO3, far passare l’anidride solforosa attraverso la soluzione finché non smette di emettere anidride carbonica, quindi concentrare la soluzione.
- Un altro metodo prevede la reazione con cloruro di potassio e acido solforico in una soluzione. La reazione produce acido cloridrico e KHSO3. Dopo il raffreddamento, la soluzione viene sottoposta attivamente a filtrazione per separare il solido KHSO3.
- Un terzo metodo prevede la reazione con idrossido di potassio e acido solforico in una soluzione. La reazione produce acqua e KHSO3. Per purificare il KHSO3, la soluzione può essere ricristallizzata.
Usi del bisolfito di potassio
Ecco alcuni usi di KHSO3:
- Agente sterilizzante: utilizzato come agente sterilizzante nella produzione di bevande alcoliche. Impedisce la crescita di batteri e funghi che potrebbero rovinare il vino o la birra.
- Conservante: utilizzato come conservante e antiossidante negli alimenti. Inibisce l’imbrunimento e l’ossidazione di frutta, verdura, succhi, salse e alimenti secchi.
- Agente riducente: utilizzato come agente riducente in chimica organica. Può ridurre aldeidi, chetoni, gruppi nitro, solfoni e solfossidi ai loro corrispondenti alcoli, ammine, solfuri e solfuri.
- Candeggina: utilizzata come agente sbiancante nell’industria tessile e della carta. Può rimuovere colore e macchie dai tessuti e dalla polpa.
- Utilizzato come fonte di anidride solforosa in varie applicazioni. Può rilasciare anidride solforosa se riscaldato o miscelato con acidi. L’anidride solforosa è un fumigante, disinfettante, solvente e catalizzatore.
Domande:
D: Quanto bisolfito di potassio deve essere disinfettato?
R: La quantità di KHSO3 necessaria per la disinfezione dipende dalla concentrazione della soluzione e dagli specifici microrganismi presi di mira. Si consiglia di seguire le istruzioni riportate sull’etichetta del prodotto o di chiedere consiglio ad un professionista qualificato.
D: Qual è la formula del bisolfito di potassio?
R: La formula chimica del bisolfito di potassio è KHSO3.
D: Il bisolfito di potassio è sicuro?
R: KHSO3 è generalmente sicuro se usato secondo le istruzioni. Tuttavia, può essere irritante per la pelle, gli occhi e il sistema respiratorio. Può anche causare reazioni allergiche in alcune persone. È importante maneggiare e conservare KHSO3 correttamente e utilizzare dispositivi di protezione se necessario.
D: Per quanto tempo è utile il bisolfito di potassio?
R: La durata di conservazione di KHSO3 dipende da vari fattori quali condizioni di conservazione, concentrazione e purezza del prodotto. Generalmente può durare diversi anni se conservato in un luogo fresco e asciutto in un contenitore ermeticamente chiuso.
D: Come reagiscono NaHSO3 e lo iodato di potassio per produrre una reazione dello iodio con le equazioni dell’amido?
R: La reazione di NaHSO3 e iodato di potassio produce iodio, che può quindi reagire con l’amido per formare un complesso blu-nero. Le equazioni della reazione sono: 5NaHSO3 + KIO3 → 5NaHSO4 + KI + 3H2O + I2 I2 + amido → complesso blu-nero
