Il bifluoruro di ammonio (NH5F2) è un composto chimico. Si dissolve in acqua e forma acido fluoridrico. Può attaccare il vetro e corrodere i metalli.
| Nome dell’IUPAC | Fluoruro di idrogeno e ammonio |
| Formula molecolare | [NH4] [HF2] |
| numero CAS | 1341-49-7 |
| Sinonimi | Fluoruro acido di ammonio, fluoruro di ammonio, difluoruro di ammonio, difluoruro di idrogeno di ammonio, difluoruro di idrogeno di ammonio |
| InChI | InChI=1S/F2H.H3N/c1-3-2;/h;1H3/q-1;/p+1 |
Proprietà del bifluoruro di ammonio
Formula del bifluoruro di ammonio
La formula del bifluoruro di ammonio è [NH4][HF2] o [NH4]F·HF. Ciò indica che il composto contiene un catione ammonio ([NH4]+) e un anione bifluoruro o idrogeno (difluoruro) ([HF2]−). La formula può anche essere scritta come NH5F2, che indica il numero di atomi di ciascun elemento nel composto.
Massa molare del bifluoruro di ammonio
La massa molare del difluoruro di ammonio è 57,044 g/mol. Si calcola sommando le masse atomiche degli elementi nella formula: (14.007 + 4 × 1.008) + (2 × 18.998) = 57.044 g/mol.
Punto di ebollizione del bifluoruro di ammonio
Il punto di ebollizione del difluoruro di ammonio è 240 ° C (464 ° F; 513 K). Tuttavia, il composto si decompone prima di raggiungere questa temperatura, liberando gas di ammoniaca e acido fluoridrico 1 . Pertanto, il difluoruro di ammonio non ha un vero punto di ebollizione.
Bifluoruro di ammonio Punto di fusione
Il punto di fusione del difluoruro di ammonio è 126 ° C (259 ° F; 399 K). Questa è la temperatura alla quale il composto solido si trasforma in un liquido. Il punto di fusione dipende dalla forza delle forze intermolecolari tra le molecole del composto.
Densità del bifluoruro di ammonio g/ml
La densità del difluoruro di ammonio è 1,50 g/ml. È la massa del composto per unità di volume. La densità può essere misurata dividendo la massa di un campione per il suo volume. La densità di una sostanza dipende dalla sua struttura molecolare e dal suo imballaggio.
Peso molecolare del bifluoruro di ammonio
Il peso molecolare del difluoruro di ammonio è 57,044 g/mol. Corrisponde alla massa molare del composto. Il peso molecolare può essere utilizzato per calcolare il numero di moli di una sostanza in una determinata massa o volume.
Struttura del bifluoruro di ammonio
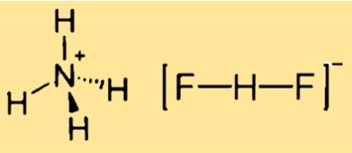
La struttura del difluoruro di ammonio è cubica, correlata alla struttura CsCl. Ciò significa che il composto ha un reticolo cristallino con una cella unitaria cubica, dove ciascun catione ammonio è circondato da quattro centri di fluoruro in un tetraedro e ciascun anione difluoruro è lineare. La struttura può essere rappresentata da un modello tridimensionale o da uno schema bidimensionale.
Solubilità del bifluoruro di ammonio
La solubilità del difluoruro di ammonio in acqua è di 63 g/100 ml a 20°C. Ciò significa che a questa temperatura in 100 ml di acqua si possono sciogliere 63 grammi di composto. La solubilità dipende dalla polarità e dalla capacità di legame idrogeno del composto e del solvente.
| Aspetto | Cristalli incolori o cristallo bianco |
| Densità specifica | 1,50 |
| Colore | Incolore |
| Odore | Leggermente piccante, piccante |
| Massa molare | 57,044 g/mole |
| Densità | 1,50 g/cm3 |
| Punto di fusione | 126°C (259°F; 399K) |
| Punto di ebollizione | 240 ° C (464 ° F; 513 K) (si decompone) |
| Punto flash | Non infiammabile |
| solubilità in acqua | 63 g/100 ml (20°C) |
| Solubilità | Leggermente solubile in alcool, insolubile in ammoniaca liquida |
| Pressione del vapore | Non disponibile |
| Densità del vapore | Non disponibile |
| pKa | Non disponibile |
| pH | Non disponibile |
Sicurezza e pericoli del bifluoruro di ammonio
Il difluoruro di ammonio è una sostanza chimica tossica e corrosiva che può farti male se lo ingerisci, lo respiri o lo tocchi. Può causare gravi ustioni e danni agli occhi, sangue dal naso, tosse, respiro sibilante, mancanza di respiro, nausea, vomito e perdita di appetito. Può anche rilasciare acido fluoridrico quando riscaldato, che è molto pericoloso da inalare. È necessario evitare il contatto con questa sostanza chimica e indossare guanti, indumenti e protezioni per gli occhi e il viso protettivi durante la manipolazione. Se sei esposto, dovresti sciacquare immediatamente con acqua e consultare un medico. Dovresti anche lavare eventuali indumenti contaminati prima di riutilizzarli.
| Simboli di pericolo | T,C |
| Descrizione della sicurezza | S26, S36/37/39, S45 |
| Numeri di identificazione delle Nazioni Unite | ONU 1727 (solido), ONU 2817 (soluzione) |
| Codice SA | 2826.19 |
| Classe di pericolo | 8 |
| Gruppo di imballaggio | II |
| Tossicità | LD50 orale (ratto) = 200 mg/kg |
Metodi per la sintesi del bifluoruro di ammonio
Vengono utilizzati diversi metodi per preparare il difluoruro di ammonio, un sale inorganico. Alcuni dei metodi comuni sono:
- Processo in fase vapore: questo metodo prevede la reazione del gas di ammoniaca e del gas di acido fluoridrico ad alte temperature e pressioni. Il prodotto è una polvere di difluoruro di ammonio secca e pura. Tuttavia, questo metodo richiede attrezzature complesse e investimenti elevati.
- Metodo in fase liquida: questo metodo prevede la reazione di soluzioni acquose di ammoniaca e acido fluoridrico o fluoruro di ammonio e acido fluoridrico a temperatura e pressione moderate. Il prodotto è un cristallo di difluoruro di ammonio umido e meno puro. Le persone utilizzano ampiamente questo metodo perché è semplice, ma il prodotto è di scarsa qualità e tende ad assorbire umidità e torta.
- Metodo di neutralizzazione: questo metodo prevede la reazione di una soluzione insatura di fluoruro di ammonio e acido fluoridrico , seguita dall’aggiunta di una soluzione di ammoniaca per neutralizzare l’acido fluoridrico in eccesso. Il prodotto è un cristallo di difluoruro di ammonio relativamente puro e stabile. Questo metodo può migliorare la qualità del prodotto e ridurre l’inquinamento ambientale.
Usi del bifluoruro di ammonio
Il difluoruro di ammonio è un sale inorganico che ha vari usi in diversi settori. Alcuni degli usi comuni sono:
- Vetro acidato: il difluoruro di ammonio può attaccare la componente di silice del vetro e creare motivi o disegni sulla superficie. Può anche rimuovere macchie e ruggine dalla vetreria.
- Lavorazione dei metalli: il difluoruro di ammonio può agire come agente complessante con alcuni metalli e migliorare la qualità e l’aspetto della galvanica. Può anche rimuovere ossidi e incrostazioni dalle superfici metalliche.
- Produzione ceramica: utilizzato come fondente nella preparazione di smalti e smalti ceramici. Può anche abbassare il punto di fusione e la viscosità di alcuni materiali ceramici.
- Sintesi organica: utilizzato come catalizzatore o reagente in alcune reazioni organiche, come la fluorurazione, la deprotezione e la scissione.
- Digestione minerale: utilizzato anche come potente agente fluorurante per convertire alcuni minerali e ossidi refrattari in fluoruri solubili. Ciò può facilitare il recupero dei metalli preziosi dai minerali.
Domande:
D: Qual è la densità apparente dei sali di bifluoruro di ammonio?
R: La densità apparente dei sali di difluoruro di ammonio è 1,5 g/cm3.
D: A cosa serve il bifluoruro di ammonio?
R: Il difluoruro di ammonio viene utilizzato per vari scopi, come l’incisione del vetro, la lavorazione dei metalli, la produzione di ceramica, la sintesi organica e la digestione dei minerali.
D: Come incidere il vetro con bifluoruro di ammonio?
R: Per incidere il vetro con difluoruro di ammonio, è necessario preparare una soluzione di sale in acqua e applicarla sulla superficie del vetro con un pennello o uno stencil. La soluzione reagirà con la componente di silice del vetro e creerà motivi o disegni. È necessario sciacquare il vetro con acqua e asciugarlo dopo l’incisione.
D: Il bifluoruro di ammonio è sicuro sulle ruote cromate?
R: Il difluoruro di ammonio non è sicuro sulle ruote cromate perché può corrodere il metallo e danneggiare la finitura. Può anche causare gravi ustioni e danni agli occhi se entra in contatto con la pelle o gli occhi. Dovresti evitare di usare il difluoruro di ammonio sulle ruote cromate e usare invece un detergente adatto.
D: Qual è la durata di conservazione del bifluoruro di ammonio?
R: La durata di conservazione del difluoruro di ammonio dipende dalle condizioni di conservazione e dalla purezza del prodotto. Generalmente può durare diversi anni se conservato in un luogo fresco, asciutto e ben ventilato in un contenitore ermeticamente chiuso. Tuttavia, può assorbire l’umidità dall’aria e formare grumi o torte nel tempo. È necessario verificare l’aspetto e la qualità del prodotto prima di utilizzarlo.
D: Il bifluoruro di ammonio è un acido?
R: Il difluoruro di ammonio non è un acido, ma un sale che contiene un catione di ammonio ([NH4]+) e un anione difluoruro o idrogeno (difluoruro) ([HF2]−). Tuttavia, può agire come un composto acido-base, poiché può rilasciare fluoruro di idrogeno (HF), un acido forte, quando riscaldato o disciolto in acqua.
