Il bicromato di sodio è un composto chimico. È un agente ossidante e una sostanza altamente tossica. Viene utilizzato in vari processi industriali, come la placcatura dei metalli e la produzione di pigmenti.
| Nome IUPAC | Dicromato di sodio |
| Formula molecolare | Na2Cr2O7 |
| numero CAS | 10588-01-9 |
| Sinonimi | Dicromato di sodio, Dicromato disodico, Dicromato di sodio |
| InChI | InChI=1S/2Cr.2Na.7O/q2*+6;2*+1;7*-2 |
Proprietà del bicromato di sodio
Formula del bicromato di sodio
La formula del bicromato di sodio è Na2Cr2O7. È costituito da due atomi di sodio (Na), due atomi di cromo (Cr) e sette atomi di ossigeno (O). La formula rappresenta il rapporto di ciascun elemento nel composto.
Massa molare del bicromato di sodio
La massa molare del bicromato di sodio si calcola sommando le masse atomiche di tutti i suoi elementi costitutivi. Il sodio (Na) ha una massa atomica di 22,99 g/mol, il cromo (Cr) ha una massa di 51,99 g/mol e l’ossigeno (O) ha una massa di 16,00 g/mol. Sommando questi valori si ottiene una massa molare di 261,97 g/mol per il dicromato di sodio.
Punto di ebollizione del bicromato di sodio
Il bicromato di sodio ha un punto di ebollizione di circa 400°C (752°F). Questa è la temperatura alla quale il composto passa dalla fase liquida a quella gassosa quando riscaldato a pressione atmosferica normale.
Dicromato di sodio Punto di fusione
Il punto di fusione del bicromato di sodio è di circa 357°C (675°F). Questa è la temperatura alla quale il composto solido si trasforma nello stato liquido. È importante notare che il punto di fusione può variare leggermente a seconda della purezza del campione.
Densità del bicromato di sodio g/mL
La densità del bicromato di sodio è di circa 2,52 g/mL. La densità è una misura della massa di una sostanza per unità di volume. Nel caso del bicromato di sodio, questo valore indica che un dato volume del composto è relativamente pesante.
Peso molecolare del bicromato di sodio
Il peso molecolare del bicromato di sodio è 261,97 g/mol. Questo valore rappresenta la somma dei pesi atomici di tutti gli atomi presenti in una molecola del composto.
Struttura del bicromato di sodio
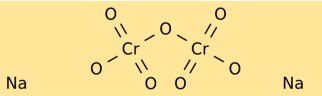
Il bicromato di sodio ha una struttura cristallina che forma cristalli rosso-arancio brillanti. È costituito da ioni sodio (Na+) e ioni dicromato (Cr2O7^2-). Lo ione bicromato ha un atomo centrale di cromo legato a due atomi di ossigeno su un lato e tre atomi di ossigeno sull’altro.
Solubilità del bicromato di sodio
Il bicromato di sodio è molto solubile in acqua. Si scioglie facilmente in acqua, formando una soluzione di colore giallo-arancio. La solubilità del bicromato di sodio in acqua è influenzata da fattori quali temperatura e pH, con temperature più elevate e livelli di pH più bassi che ne aumentano la solubilità.
| Aspetto | Cristalli rosso-arancio |
| Peso specifico | 2.52 |
| Colore | Rosso-arancio brillante |
| Odore | Inodore |
| Massa molare | 261,97 g/mole |
| Densità | 2,52 g/ml |
| Punto di fusione | 357°C (675°F) |
| Punto di ebollizione | 400°C (752°F) |
| Punto flash | Non applicabile |
| solubilità in acqua | Molto solubile |
| Solubilità | Solubile in acqua, leggermente solubile in etanolo/metanolo |
| Pressione del vapore | Non disponibile |
| Densità del vapore | Non disponibile |
| pKa | Non disponibile |
| pH | Non disponibile |
Sicurezza e pericoli del bicromato di sodio
Il bicromato di sodio presenta notevoli rischi per la sicurezza. È altamente tossico se ingerito, inalato o assorbito attraverso la pelle. Ciò può causare gravi ustioni e danni agli occhi in caso di contatto. Il composto è anche classificato come potenziale cancerogeno, in grado di provocare il cancro. Inoltre, è un agente ossidante, il che significa che può reagire violentemente con materiali combustibili, aumentando il rischio di incendio o esplosione. È necessario adottare adeguate precauzioni di sicurezza durante la manipolazione del dicromato di sodio, compreso l’uso di indumenti protettivi, guanti e occhiali. Dovrebbe essere conservato in un’area sicura e ben ventilata, lontano da sostanze incompatibili. Se esposto o ingerito, l’intervento medico immediato è fondamentale.
| Simboli di pericolo | Corrosivo, pericolo per la salute |
| Descrizione della sicurezza | Molto tossico, corrosivo, cancerogeno |
| Numeri di identificazione delle Nazioni Unite | UN3086 |
| Codice SA | 28415000 |
| Classe di pericolo | 6.1 |
| Gruppo di imballaggio | II |
| Tossicità | Molto tossico |
Metodi per la sintesi del bicromato di sodio
Esistono diversi metodi per sintetizzare il bicromato di sodio. Un metodo comunemente utilizzato è la reazione tra cromato di sodio (Na2CrO4) e dicromato di sodio (Na2Cr2O7). L’acido solforico (H2SO4) reagisce con il cromato di sodio, producendo bicromato di sodio e acqua. L’equazione chimica per questa reazione è:
2Na2CrO4 + 2H2SO4 → Na2Cr2O7 + Na2SO4 + H2O
Un altro metodo prevede l’ossidazione del cromato di sodio utilizzando un forte agente ossidante, come il permanganato di potassio (KMnO4) . In questa reazione, il cromato di sodio reagisce con il permanganato di potassio in presenza di acido solforico per produrre bicromato di sodio, biossido di manganese (MnO2) e acqua.
2Na2CrO4 + 6KMnO4 + 7H2SO4 → 2Na2Cr2O7 + 6MnO2 + 7K2SO4 + 8H2O
La reazione tra idrossido di sodio (NaOH) e triossido di cromo (CrO3) produce dicromato di sodio. La reazione avviene in un mezzo acquoso e produce bicromato di sodio e acqua.
2NaOH + CrO3 → Na2Cr2O7 + H2O
Quando si implementano questi metodi sintetici, le persone dovrebbero prestare attenzione a causa della natura tossica e pericolosa del dicromato di sodio. L’uso di misure di sicurezza e dispositivi di protezione adeguati è fondamentale per garantire il benessere delle persone coinvolte nel processo.
Usi del bicromato di sodio
Il bicromato di sodio ha varie applicazioni in diversi settori. Ecco alcuni dei suoi usi:
- Placcatura dei metalli: i processi di galvanica utilizzano il dicromato di sodio per applicare un rivestimento protettivo e decorativo su varie superfici metalliche, come acciaio, alluminio e zinco.
- Produzione di pigmenti: il dicromato di sodio svolge un ruolo vitale nella produzione di pigmenti come il giallo cromo e il verde cromo, ampiamente presenti nelle vernici, negli inchiostri e nei coloranti.
- Conservante del legno: il bicromato di sodio, con le sue forti proprietà ossidanti, preserva il legno dalla putrefazione, dagli insetti e dai funghi, soprattutto nelle applicazioni esterne.
- Concia della pelle: l’industria conciaria utilizza il dicromato di sodio come mordente durante il processo di trattamento della pelle, migliorando così la solidità del colore e la durata della pelle.
- Sintesi chimica: il dicromato di sodio agisce come reagente in varie reazioni chimiche, tra cui la sintesi di composti organici, reazioni di ossidazione e la preparazione di altri composti di cromo.
- Applicazioni di laboratorio: il bicromato di sodio trova applicazioni di laboratorio per test analitici, standard di calibrazione e ricerca chimica.
- Industria tessile: il bicromato di sodio migliora la solidità del colore e favorisce una migliore adesione dei coloranti al tessuto durante i processi di tintura e stampa dei tessuti.
- Fotografia: il dicromato di sodio è un componente cruciale nelle emulsioni fotosensibili e funziona come agente ossidante in alcuni processi fotografici.
È importante maneggiare il bicromato di sodio con cura, seguendo le istruzioni di sicurezza e i metodi di smaltimento adeguati, a causa della sua tossicità e dell’impatto sull’ambiente.
Domande:
D: Quanti atomi di ossigeno ci sono in 3,00 g di bicromato di sodio, Na2Cr2O7?
R: Ci sono 6,02 x 10^22 atomi di ossigeno in 3,00 g di bicromato di sodio.
D: Quanti atomi di ossigeno ci sono in 4,00 g di bicromato di sodio, Na2Cr2O7?
R: Ci sono 8,03 x 10^22 atomi di ossigeno in 4,00 g di bicromato di sodio.
D: Quanti atomi di ossigeno ci sono in 5,00 g di bicromato di sodio, Na2Cr2O7?
R: Ci sono 1,00 x 10^23 atomi di ossigeno in 5,00 g di bicromato di sodio.
D: Quanti atomi di ossigeno ci sono in 6,00 g di bicromato di sodio, Na2Cr2O7?
R: Ci sono 1,20 x 10^23 atomi di ossigeno in 6,00 g di bicromato di sodio.
D: Quanti atomi di ossigeno ci sono in 7,00 g di bicromato di sodio?
R: Ci sono 1,40 x 10^23 atomi di ossigeno in 7,00 g di bicromato di sodio.
D: Scheda di sicurezza del bicromato di sodio?
R: La scheda dati di sicurezza del materiale (MSDS) per il dicromato di sodio fornisce informazioni dettagliate sulle sue proprietà, precauzioni per la manipolazione e misure di sicurezza.
D: Cosa potrebbe sostituire il bicromato di sodio?
R: Le alternative al bicromato di sodio includono altri composti del cromo, come i sali di cromo trivalente o sostanze non contenenti cromo, a seconda dell’applicazione specifica.
D: A cosa serve il bicromato di sodio?
R: Il dicromato di sodio viene utilizzato come agente ossidante, conservante del legno e pigmento, nonché in vari processi industriali come la placcatura dei metalli e la concia della pelle.
D: La soluzione di cromato giallo può essere prodotta da dicromato di sodio diidrato?
R: Sì, è possibile preparare una soluzione di cromato giallo sciogliendo il bicromato di sodio diidrato in acqua.
D: Qual è la formula del bicromato di sodio?
R: La formula del bicromato di sodio è Na2Cr2O7.
D: Il bicromato di sodio è inorganico?
R: Sì, il bicromato di sodio è un composto inorganico.
D: Cosa rileva il bicromato di sodio?
R: Il dicromato di sodio può essere utilizzato a scopo di test, ad esempio per valutare la presenza di determinate sostanze o monitorare reazioni chimiche specifiche.
