Il bicarbonato di sodio (NaHCO3), noto anche come bicarbonato di sodio, è una polvere cristallina bianca con un leggero sapore alcalino. È comunemente usato come agente lasciando nella cottura, come detergente e nel trattamento dell’indigestione acida e del bruciore di stomaco.
| Nome IUPAC | Sodio idrogeno carbonato |
| Formula molecolare | NaHCO3 |
| numero CAS | 144-55-8 |
| Sinonimi | Bicarbonato di sodio, carbonato acido di sodio, carbonato acido di sodio |
| InChI | InChI=1S/CHNaO3/c2-1(3)4/h(H,2,3)(H2,1,2,3)/p-1 |
Proprietà del bicarbonato di sodio
Massa molare del bicarbonato di sodio
La massa molare di NaHCO3 è 84.007 g/mol. È la somma delle masse atomiche dei suoi elementi costitutivi: sodio, idrogeno, carbonio e ossigeno.
Punto di ebollizione del bicarbonato di sodio
L’idrogenocarbonato di sodio non ha un punto di ebollizione fisso perché si decompone prima di essere bollito. La temperatura di decomposizione del bicarbonato di sodio è di 851°C, momento in cui si scompone in carbonato di sodio, anidride carbonica e acqua.
Punto di fusione del bicarbonato di sodio
Il carbonato acido di sodio ha un punto di fusione di 50°C, punto in cui cambia da solido a polvere cristallina bianca.
Densità del bicarbonato di sodio g/ml
La densità del bicarbonato di sodio è di circa 2,165 g/mL. Questo valore può variare leggermente in funzione della granulometria e del grado di compattazione del materiale.
Peso molecolare del bicarbonato di sodio
Il peso molecolare del bicarbonato di sodio è 84.007 g/mol, calcolato dalla sua formula molecolare NaHCO3.
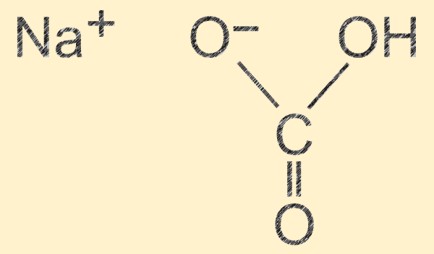
Struttura del bicarbonato di sodio
Il carbonato acido di sodio ha una struttura molecolare composta da uno ione sodio (Na+), uno ione idrogeno (H+), uno ione carbonato (CO32-) e tre ioni ossigeno (O2-). Gli ioni sono disposti in un’unità ripetitiva che forma una struttura cristallina, con un legame idrogeno tra le molecole. La natura ionica del composto gli conferisce le sue proprietà fondamentali e il legame idrogeno contribuisce alla sua stabilità fisica.
| Aspetto | Polvere cristallina bianca |
| Peso specifico | 2.165 g/ml |
| Colore | Bianco |
| Odore | Inodore |
| Massa molare | 84.007 g/mole |
| Densità | 2.165 g/ml |
| Punto di fusione | 50°C |
| Punto di ebollizione | Si decompone a 851°C |
| Punto flash | Non applicabile |
| solubilità in acqua | Solubile in acqua |
| Solubilità | Solubile in acqua |
| Pressione del vapore | Non applicabile |
| Densità del vapore | Non applicabile |
| pKa | 8.1 |
| pH | 8,1 (10 g/l, 25°C) |
Sicurezza e pericoli del bicarbonato di sodio
Il bicarbonato di sodio è un composto sicuro e comunemente usato con un basso livello di tossicità. È generalmente considerato non pericoloso, non infiammabile e non esplosivo. L’ingestione di grandi quantità può causare disturbi digestivi e aumentare il rischio di sviluppare calcoli renali. Il contatto con la pelle può causare leggera irritazione e l’inalazione di polveri può causare irritazione delle vie respiratorie. È importante maneggiare NaHCO3 con cura per evitare l’inalazione di polvere e il contatto con la pelle.
| Simboli di pericolo | Non applicabile |
| Descrizione della sicurezza | S24/25 |
| Numeri di identificazione delle Nazioni Unite | UN3077, MATERIA PERICOLOSA PER L’AMBIENTE, SOLIDA, NAS (Bicarbonato di sodio) |
| Codice SA | 2836.90.90 |
| Classe di pericolo | 9 |
| Gruppo di imballaggio | III |
| Tossicità | Bassa tossicità se ingerito, inalato o a contatto con la pelle |
Metodi per la sintesi del bicarbonato di sodio
Il bicarbonato di sodio (NaHCO3) può essere sintetizzato con diversi metodi, incluso il processo Solvay, che è il metodo più comunemente utilizzato per la produzione su larga scala. Il processo Solvay prevede la reazione di cloruro di sodio, ammoniaca e anidride carbonica per produrre idrogenocarbonato di sodio e cloruro di calcio. Il carbonato acido di sodio può anche essere sintetizzato dalla reazione di NaHCO3 e anidride carbonica, o dalla reazione di idrossido di sodio e anidride carbonica. Questi metodi producono una forma di NaHCO3 ad elevata purezza, che può essere ulteriormente purificata mediante ricristallizzazione.
Usi del bicarbonato di sodio
Il carbonato acido di sodio, comunemente noto come bicarbonato di sodio, ha una vasta gamma di usi grazie alle sue proprietà uniche. In cucina viene spesso utilizzato come agente lievitante per prodotti da forno, come torte e pane. Nella cura personale, viene utilizzato come leggero abrasivo nel dentifricio e come deodorante. Viene utilizzato anche nell’industria alimentare come regolatore del pH e agente neutralizzante. Il carbonato acido di sodio ha anche usi medicinali, come il trattamento del bruciore di stomaco, dell’indigestione e dell’acidità. Inoltre, viene utilizzato nella produzione di prodotti per la pulizia ed estintori grazie alle sue proprietà estinguenti. Il carbonato acido di sodio ha anche usi ambientali, poiché può essere utilizzato per neutralizzare le acque reflue acide.
