Il bicarbonato di calcio (Ca(HCO3)2) è un composto che contiene calcio, carbonio e ossigeno. Si trova comunemente nell’acqua minerale ed è importante per la salute delle ossa e la funzione muscolare.
| Nome IUPAC | Carbonato acido di calcio |
| Formula molecolare | Ca(HCO3)2 |
| numero CAS | 3983-19-5 |
| Sinonimi | Idrogenocarbonato di calcio, idrogenocarbonato di calcio, bicarbonato di calcio idrato, idrogenocarbonato di calcio idrato, EINECS 223-070-3 |
| InChI | InChI=1S/C2H2O3.Ca/c3-1(4)2(5)6;/h(H2,3,4)(H,5,6);/q;+2/p-2 |
Proprietà del bicarbonato di calcio
Formula di bicarbonato di calcio
La formula chimica del bicarbonato di calcio è Ca(HCO3)2. Ciò indica che il composto è costituito da uno ione Ca2+ e due ioni HCO3-. La formula è importante per comprendere la composizione del composto e le sue proprietà chimiche. Ca(HCO3)2 può essere formato sciogliendo il carbonato di calcio in acqua gassata o facendo reagire l’idrossido di calcio con l’anidride carbonica.
Massa molare del bicarbonato di calcio
La massa molare di Ca(HCO3)2 è 162,114 g/mol. Questo viene calcolato sommando le masse atomiche di ciascun elemento nel composto. Ca(HCO3)2 contiene atomi di calcio, idrogeno, carbonio e ossigeno e la massa molare riflette la massa combinata di tutti questi atomi. Conoscere la massa molare è importante per determinare la quantità di Ca(HCO3)2 necessaria per le reazioni chimiche o per determinare la concentrazione di una soluzione.
Punto di ebollizione del bicarbonato di calcio
Ca(HCO3)2 si decompone prima di raggiungere il punto di ebollizione. Alla normale pressione atmosferica, il Ca(HCO3)2 si decompone in carbonato di calcio, acqua e anidride carbonica a temperature superiori a 50°C. Non ha quindi punto di ebollizione.
Punto di fusione del bicarbonato di calcio
Il Ca(HCO3)2 non ha un punto di fusione distinto perché si decompone prima di raggiungere il punto di fusione. Si decompone in carbonato di calcio, acqua e anidride carbonica a temperature superiori a 50°C. Tuttavia, la decomposizione termica del Ca(HCO3)2 può essere utilizzata per produrre ossido di calcio, che ha un punto di fusione elevato di 2613°C.
Densità del bicarbonato di calcio g/mL
La densità di Ca(HCO3)2 è 2,21 g/mL. Ciò significa che un centimetro cubo di Ca(HCO3)2 pesa 2,21 grammi. La densità di Ca(HCO3)2 è inferiore alla densità del carbonato di calcio, che è 2,71 g/mL. La densità di una sostanza è importante per determinare la massa di una sostanza per unità di volume e può essere utilizzata per calcolare la concentrazione di una soluzione.
Peso molecolare del bicarbonato di calcio
Il peso molecolare di Ca(HCO3)2 è 162,114 g/mol. Questo valore viene calcolato sommando i pesi atomici di calcio, idrogeno, carbonio e ossigeno presenti nel composto. Il peso molecolare è importante per determinare la quantità di Ca(HCO3)2 necessaria per le reazioni chimiche e per determinare la concentrazione di una soluzione.
Struttura del bicarbonato di calcio
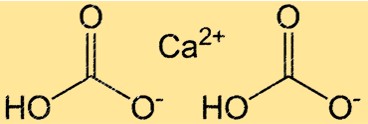
Ca(HCO3)2 ha una struttura complessa dovuta alla presenza di legami ionici e covalenti. Il composto è costituito da uno ione Ca2+ e due ioni HCO3- tenuti insieme da legami ionici. Lo stesso ione HCO3 è uno ione poliatomico costituito da un atomo di carbonio, due atomi di ossigeno e un atomo di idrogeno. L’atomo di carbonio è legato due volte a un atomo di ossigeno e è legato singolarmente all’altro, e l’atomo di idrogeno è legato a uno degli atomi di ossigeno. La struttura del Ca(HCO3)2 è importante per comprenderne la reattività e la solubilità in acqua.
| Aspetto | polvere bianca |
| Peso specifico | 2,21 g/cm³ |
| Colore | Incolore |
| Odore | Inodore |
| Massa molare | 162.114 g/mole |
| Densità | 2,21 g/ml |
| Punto di fusione | Si decompone sopra i 50°C |
| Punto di ebollizione | Si decompone sopra i 50°C |
| Punto flash | Non applicabile |
| solubilità in acqua | Solubile |
| Solubilità | Solubile in acqua, insolubile in alcool |
| Pressione del vapore | Trascurabile |
| Densità del vapore | Non applicabile |
| pKa | 6.4 – 10.3 |
| pH | 8.2 – 8.4 |
Sicurezza e pericoli del bicarbonato di calcio
Il Ca(HCO3)2 è generalmente considerato sicuro per l’uso negli alimenti e nelle bevande dagli enti regolatori. Tuttavia, l’inalazione di polvere di Ca(HCO3)2 può causare irritazione delle vie respiratorie. Il contatto con gli occhi può causare irritazione o danni alla cornea. L’ingestione di grandi quantità di Ca(HCO3)2 può causare irritazione gastrointestinale. La manipolazione del Ca(HCO3)2 può anche causare irritazioni cutanee o dermatiti in soggetti sensibili. È importante seguire le corrette procedure di manipolazione quando si lavora con Ca(HCO3)2, come indossare guanti e occhiali protettivi. Inoltre, è importante conservare Ca(HCO3)2 in un luogo fresco e asciutto e lontano da sostanze incompatibili.
| Simboli di pericolo | Nessuno |
| Descrizione della sicurezza | Non tossico e sicuro |
| Numeri di identificazione delle Nazioni Unite | N / A |
| Codice SA | 2836.50.00 |
| Classe di pericolo | Non pericoloso |
| Gruppo di imballaggio | N / A |
| Tossicità | Non tossico e sicuro |
Metodi per la sintesi del bicarbonato di calcio
La reazione del carbonato di calcio (CaCO3) con l’anidride carbonica (CO2) e l’acqua (H2O) sintetizza Ca(HCO3)2. Questa reazione può verificarsi naturalmente in alcuni corpi idrici, dove sono presenti anidride carbonica e carbonato di calcio .
Per produrre Ca(HCO3)2, l’anidride carbonica può essere fatta passare attraverso una soluzione di idrossido di calcio (Ca(OH)2) . Questa reazione forma carbonato di calcio , che poi reagisce con l’eccesso di anidride carbonica per formare Ca(HCO3)2.
Un altro metodo per sintetizzare Ca(HCO3)2 prevede la reazione del cloruro di calcio (CaCl2) con il bicarbonato di sodio (NaHCO3). Questa reazione produce Ca(HCO3)2 nonché cloruro di sodio (NaCl) e anidride carbonica.
È importante notare che Ca(HCO3)2 è un composto relativamente instabile e si decompone in carbonato di calcio e anidride carbonica in presenza di calore o condizioni acide. Per evitare la decomposizione, il Ca(HCO3)2 deve essere maneggiato e conservato con cura.
Usi del bicarbonato di calcio
Ecco alcuni usi comuni di Ca(HCO3)2:
- Alimenti e bevande: utilizzato come additivo alimentare nella produzione di alcuni prodotti da forno, agenti lasciando e bevande analcoliche.
- Trattamento dell’acqua: utilizzato per aumentare l’alcalinità dell’acqua, contribuendo a prevenire la corrosione dei tubi e a ridurre l’acidità delle fonti d’acqua acide.
- Agricoltura: utilizzato come ammendante per aumentare il contenuto di calcio del suolo, che può migliorare la struttura del suolo e la crescita delle piante.
- Prodotti farmaceutici: utilizzati in alcune formulazioni antiacidi come agente neutralizzante per alleviare il bruciore di stomaco e l’indigestione.
- Edilizia: utilizzato come fonte di calcio nella produzione di alcuni materiali da costruzione, come cemento e intonaco.
- Pulizia: utilizzato come leggero abrasivo in alcuni prodotti per la pulizia, come dentifricio e polveri detergenti.
- Cosmetici: utilizzato come agente tampone in alcune formulazioni cosmetiche per aiutare a mantenere il pH del prodotto.
Domande:
D: Cos’è il bicarbonato di calcio?
R: Ca(HCO3)2 è una polvere cristallina bianca che si forma quando il carbonato di calcio reagisce con l’anidride carbonica e l’acqua.
D: Quali tre sostanze devono interagire per formare il bicarbonato di calcio?
R: Il carbonato di calcio, l’anidride carbonica e l’acqua devono interagire per formare Ca(HCO3)2.
D: Il bicarbonato di calcio è un agente lievitante?
R: Sì, il Ca(HCO3)2 può essere utilizzato come agente lievitante nella cottura al forno per favorire la lievitazione dell’impasto.
D: I cristalli auricolari di bicarbonato di calcio si dissolvono mai?
R: Sì, i cristalli auricolari di Ca(HCO3)2 possono dissolversi da soli o con il trattamento, ad esempio attraverso l’uso di determinati farmaci o manovre.
D: Qual è il numero totale di moli di atomi in una mole di Ca(HCO3)2?
R: Ci sono 10 moli di atomi in una mole di Ca(HCO3)2.
D: Quanti atomi ci sono nel Ca(HCO3)2?
R: Ci sono un totale di 18 atomi presenti nel Ca(HCO3)2, inclusi 1 atomo di calcio, 2 atomi di carbonio, 6 atomi di idrogeno e 9 atomi di ossigeno.
D: Cos’è il Ca(HCO3)2?
R: Ca(HCO3)2 è la formula chimica del bicarbonato di calcio, che è un composto formato quando il carbonato di calcio reagisce con l’anidride carbonica e l’acqua.
