L’anilina (C6H5NH2) è un’ammina aromatica utilizzata nella produzione di coloranti, prodotti farmaceutici e prodotti chimici per la gomma. Ha un odore distinto ed è un precursore di vari composti organici.
| Nome IUPAC | Anilina |
| Formula molecolare | C6H7N |
| numero CAS | 62-53-3 |
| Sinonimi | Aminobenzene, Benzenamina |
| InChI | InChI=1S/C6H7N/c7-6-4-2-1-3-5-6/h1-5H,7H2 |
Proprietà dell’anilina
Formula dell’anilina
La formula dell’anilina è C6H7N. È costituito da sei atomi di carbonio, sette atomi di idrogeno e un atomo di azoto. La disposizione di questi atomi conferisce all’anilina le sue proprietà chimiche uniche.
Massa molare dell’anilina
La massa molare di C6H5NH2 si calcola sommando le masse atomiche di tutti i suoi elementi costitutivi. La massa molare di C6H5NH2 è di circa 93,13 grammi per mole (g/mol). Questo valore è utile in vari calcoli chimici e reazioni che coinvolgono C6H5NH2.
Punto di ebollizione dell’anilina
C6H5NH2 ha un punto di ebollizione di circa 184 gradi Celsius (184°C). A questa temperatura, C6H5NH2 subisce un cambiamento di fase da liquido a gassoso. Il punto di ebollizione è una caratteristica importante che determina le condizioni in cui C6H5NH2 può essere vaporizzato.
Punto di fusione dell’anilina
Il punto di fusione di C6H5NH2 è di circa -6 gradi Celsius (-6°C). Questa è la temperatura alla quale il solido C6H5NH2 si trasforma nello stato liquido. Il punto di fusione è importante per determinare lo stato fisico di C6H5NH2 in diverse condizioni di temperatura.
Densità dell’anilina g/mL
C6H5NH2 ha una densità di circa 1,02 grammi per millilitro (g/mL). La densità rappresenta la massa di una sostanza per unità di volume. Il valore di densità di C6H5NH2 fornisce informazioni sulla sua compattezza o concentrazione in un dato volume di spazio.
Peso molecolare dell’anilina
Il peso molecolare di C6H5NH2 è di circa 93,13 grammi per mole (g/mol). È la somma dei pesi atomici di tutti gli atomi nella formula chimica di C6H5NH2. Il peso molecolare gioca un ruolo cruciale nei calcoli stechiometrici e nel determinare la quantità di C6H5NH2 necessaria per le reazioni.
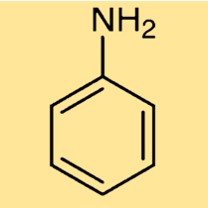
Struttura dell’anilina
C6H5NH2 ha una struttura costituita da un anello benzenico (un anello esagonale di atomi di carbonio) con un gruppo amminico attaccato (-NH2) al posto di un atomo di idrogeno. Questa struttura conferisce a C6H5NH2 le sue proprietà aromatiche e basiche, rendendolo utile in varie applicazioni industriali.
Solubilità dell’anilina
C6H5NH2 è scarsamente solubile in acqua ma si dissolve facilmente in solventi organici come etanolo, etere e cloroformio. La sua solubilità è influenzata dalla polarità e dalle forze intermolecolari tra C6H5NH2 e il solvente. Questa proprietà consente a C6H5NH2 di essere facilmente incorporato in diversi processi chimici e formulazioni.
| Aspetto | Liquido da incolore a giallo pallido |
| Peso specifico | 1,02 g/ml |
| Colore | Da incolore a giallo pallido |
| Odore | Odore caratteristico |
| Massa molare | 93,13 g/mole |
| Densità | 1,02 g/ml |
| Punto di fusione | -6°C |
| Punto di ebollizione | 184°C |
| Punto flash | 70°C |
| solubilità in acqua | Scarsamente solubile |
| Solubilità | Solubile in solventi organici |
| Pressione del vapore | 5,60 mmHg |
| Densità del vapore | 3,24 (aria=1) |
| pKa | 4.61 |
| pH | Circa neutro |
Sicurezza e pericoli dell’anilina
C6H5NH2 presenta potenziali rischi per la sicurezza e deve essere maneggiato con cautela. È nocivo se ingerito, inalato o assorbito attraverso la pelle. Il contatto diretto con C6H5NH2 può causare irritazione agli occhi, alla pelle e al sistema respiratorio. L’esposizione prolungata o ripetuta può causare effetti più gravi, tra cui dermatiti e disturbi del sangue. Anche C6H5NH2 è infiammabile ed i suoi vapori possono formare miscele esplosive nell’aria. Quando si lavora con C6H5NH2 è necessario utilizzare una ventilazione adeguata e dispositivi di protezione individuale. Le corrette pratiche di stoccaggio, movimentazione e smaltimento sono essenziali per ridurre al minimo i rischi e garantire la sicurezza delle persone e dell’ambiente.
| Simboli di pericolo | T, N |
| Descrizione della sicurezza | Evitare il contatto con la pelle e gli occhi. Utilizzare in un’area ben ventilata. Manipolare con guanti e indumenti protettivi. |
| Numeri di identificazione delle Nazioni Unite | ONU 1547 |
| Codice SA | 2921.43.0000 |
| Classe di pericolo | 6.1 (Sostanze tossiche) |
| Gruppo di imballaggio | III |
| Tossicità | Tossico se ingerito, inalato o assorbito attraverso la pelle. Può causare irritazioni, dermatiti e disturbi del sangue. |
Metodi di sintesi dell’anilina
Vari metodi possono sintetizzare C6H5NH2.
Un metodo comune è la riduzione del nitrobenzene . In questo processo, un agente riducente, come la limatura di ferro o lo stagno, reagisce con il nitrobenzene in presenza di un acido forte, come l’acido cloridrico. Questa reazione comporta la conversione del gruppo nitro (-NO2) in un gruppo amminico (-NH2), producendo C6H5NH2.
Un altro metodo prevede la riduzione del nitrobenzene utilizzando idrogeno gassoso su un catalizzatore, come palladio o platino. Il metodo industriale per produrre C6H5NH2 utilizza ampiamente il processo chiamato idrogenazione catalitica.
Per ottenere C6H5NH2, nella riduzione del nitrobenzene è possibile utilizzare solfuro di sodio o bisolfito di sodio. Questi agenti riducenti facilitano la conversione del gruppo nitro nel gruppo amminico.
Per sintetizzare C6H5NH2, il clorobenzene può essere trattato con ammoniaca in presenza di una base forte, come l’idrossido di sodio. Questo processo, noto come reazione Sandmeyer, comporta la sostituzione del cloro con un gruppo amminico, risultando in C6H5NH2.
Inoltre, è possibile preparare C6H5NH2 riducendo l’azobenzene o l’azossibenzene, che comporta la rottura del legame azoto-azoto per formare un gruppo amminico.
Questi metodi di sintesi offrono diversi approcci per ottenere C6H5NH2, consentendone la produzione su scala di laboratorio e industriale. La scelta del metodo dipende da fattori quali la disponibilità delle materie prime, le condizioni di reazione e la purezza desiderata del prodotto finale.
Usi dell’anilina
C6H5NH2 trova applicazioni in vari settori grazie alle sue diverse proprietà. Ecco alcuni dei suoi usi comuni:
- Produzione di coloranti: C6H5NH2 funge da materia prima chiave per la produzione di molti coloranti, inclusi coloranti e pigmenti sintetici utilizzati nell’industria tessile, della pelle e della carta.
- Industria farmaceutica: i derivati C6H5NH2 sono cruciali nella sintesi di farmaci, come analgesici, antipiretici e agenti antimalarici.
- Prodotti chimici in gomma: C6H5NH2 migliora attivamente le prestazioni e la durata dei prodotti in gomma essendo un componente cruciale nella produzione di acceleratori e antiossidanti nell’industria della gomma.
- Erbicidi e pesticidi: gli agricoltori utilizzano attivamente i derivati C6H5NH2 nella formulazione di erbicidi e pesticidi, controllando così efficacemente erbe infestanti e parassiti in agricoltura.
- Produzione di poliuretano: C6H5NH2 è un componente essenziale nella sintesi di schiume, rivestimenti e adesivi poliuretanici, ampiamente utilizzato nell’industria edile e automobilistica.
- Intermedi chimici: C6H5NH2 funge da elemento costitutivo versatile per la sintesi di vari composti organici, come prodotti chimici per la gomma, prodotti farmaceutici e prodotti chimici per l’agricoltura.
- Solvente per varie sostanze: C6H5NH2 dissolve attivamente varie sostanze tra cui grassi, oli, cere e resine.
- Reagente di laboratorio: negli esperimenti di laboratorio di sintesi organica, i ricercatori utilizzano C6H5NH2 come reagente e lo utilizzano come catalizzatore in alcune reazioni.
- Prodotti chimici fotografici: i derivati C6H5NH2 contribuiscono attivamente alla produzione di prodotti chimici fotografici, come sviluppatori e coloranti.
- Iniziatore di polimerizzazione: C6H5NH2 agisce come iniziatore in alcune reazioni di polimerizzazione, consentendo la formazione di polimeri con proprietà specifiche.
Queste diverse applicazioni evidenziano l’importanza di C6H5NH2 in settori che vanno dal tessile e farmaceutico all’agricoltura e alla produzione.
Domande:
D: Quale composto è più basico dell’anilina?
R: L’ammoniaca (NH3) è più basica di C6H5NH2.
D: Cos’è il punto anilina?
R: Il punto C6H5NH2 è la temperatura più bassa alla quale volumi uguali di C6H5NH2 e un solvente specifico sono completamente miscibili.
D: Cos’è l’anilina?
R: L’anilina è un’ammina aromatica con la formula chimica C6H7N, comunemente utilizzata nei coloranti, nei prodotti farmaceutici e nei prodotti chimici per la gomma.
D: Come separare naftalene e anilina?
R: La naftalene e C6H5NH2 possono essere separati mediante un processo chiamato distillazione frazionata, utilizzando la differenza nei loro punti di ebollizione.
D: Come viene preparato il fenolo dall’anilina?
R: Il fenolo può essere sintetizzato da C6H5NH2 mediante un processo chiamato diazotazione, seguito da idrolisi per formare fenolo.
D: Come pulire la pelle all’anilina?
R: Per pulire la pelle C6H5NH2, utilizzare un panno morbido e umido per rimuovere delicatamente le macchie ed evitare l’uso di prodotti chimici aggressivi o umidità eccessiva.
D: Qual è la base coniugata dell’acido benzoico e l’acido coniugato dell’anilina?
R: La base coniugata dell’acido benzoico è lo ione benzoato (C6H5COO-) e l’acido coniugato di C6H5NH2 è lo ione anilinio (C6H5NH3+).
D: Cos’è la pelle all’anilina?
R: La pelle C6H5NH2 è un tipo di pelle tinta con coloranti C6H5NH2, che preserva la struttura e l’aspetto naturali della pelle pur mantenendo una sensazione morbida e lussuosa.
