L’anidride maleica (C4H2O3) è un composto chimico utilizzato in vari settori. È prodotto dall’ossidazione del benzene o del butano. Viene utilizzato principalmente nella produzione di polimeri, resine e prodotti chimici agricoli.
| Nome IUPAC | Anidride maleica |
| Formula molecolare | C4H2O3 |
| numero CAS | 108-31-6 |
| Sinonimi | Anidride cis-butenedioica, 2,5-furandione, anidride tossica, anidride dell’acido maleico |
| InChI | InChI=1S/C4H2O3/c5-3-1-2-4(6)7-3/h1-2H |
Proprietà dell’anidride maleica
Formula dell’anidride maleica
La formula dell’anidride maleica è C4H2O3. È costituito da quattro atomi di carbonio, due atomi di idrogeno e tre atomi di ossigeno. La disposizione di questi atomi conferisce all’anidride maleica le sue proprietà chimiche uniche.
Massa molare dell’anidride maleica
La massa molare dell’anidride butenedioica si calcola sommando le masse atomiche dei suoi elementi costitutivi. L’anidride maleica ha una massa molare di circa 98,06 grammi per mole. Questo valore è essenziale per vari calcoli nei processi chimici e produttivi.
Punto di ebollizione dell’anidride maleica
L’anidride butenedioica ha un punto di ebollizione di circa 202,2 gradi Celsius (396,0 gradi Fahrenheit). Questa è la temperatura alla quale il composto passa da liquido a gas quando riscaldato. Il punto di ebollizione è una caratteristica importante nel determinare le condizioni richieste per il suo utilizzo.
Anidride maleica Punto di fusione
Il punto di fusione dell’anidride butenedioica è di circa 52,8 gradi Celsius (127,0 gradi Fahrenheit). Questa è la temperatura alla quale il composto solido si trasforma nello stato liquido. Il punto di fusione è un parametro cruciale per la manipolazione e la lavorazione dell’anidride butenedioica.
Densità dell’anidride maleica g/mL
La densità dell’anidride butenedioica è di circa 1,48 grammi per millilitro (g/mL). La densità misura la massa di una sostanza per unità di volume. Questo valore aiuta a comprendere la concentrazione e il comportamento dell’anidride butenedioica in varie applicazioni.
Peso molecolare dell’anidride maleica
Il peso molecolare dell’anidride butenedioica è di circa 98,06 grammi per mole. Si calcola sommando i pesi atomici dei suoi atomi costituenti. Il peso molecolare è importante per determinare la quantità di anidride butenedioica necessaria nelle reazioni e per comprenderne le proprietà chimiche.
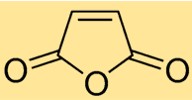
Struttura dell’anidride maleica
La struttura dell’anidride butenedioica è costituita da una molecola ciclica con un doppio legame tra due atomi di carbonio e due atomi di ossigeno attaccati allo scheletro di carbonio. Questa struttura conferisce reattività e caratteristiche specifiche all’anidride butenedioica, rendendola utile in vari processi chimici.
Solubilità dell’anidride maleica
L’anidride butenedioica è scarsamente solubile in acqua ma si dissolve facilmente in solventi organici come acetone, benzene e acetato di etile. Questo comportamento di solubilità consente una facile incorporazione dell’anidride butenedioica in diverse soluzioni e ne facilita l’utilizzo in varie applicazioni industriali.
| Aspetto | Bianco cristallino |
| Peso specifico | 1,48 g/ml |
| Colore | Incolore |
| Odore | Odore pungente |
| Massa molare | 98,06 g/mole |
| Densità | 1,48 g/ml |
| Punto di fusione | 52,8°C (127,0°F) |
| Punto di ebollizione | 202,2°C (396,0°F) |
| Punto flash | 138°C (280°F) |
| solubilità in acqua | 44 g/l a 20°C |
| Solubilità | Solubile in solventi organici |
| Pressione del vapore | 0,3 mmHg a 20°C |
| Densità del vapore | 3,39 (Aria = 1) |
| pKa | 1.2 |
| pH | ~1 (soluzione satura) |
Sicurezza e pericoli dell’anidride maleica
L’anidride butenedioica presenta alcuni rischi per la sicurezza e deve essere maneggiata con cautela. Può causare irritazione alla pelle, agli occhi e al sistema respiratorio per contatto o inalazione. Il contatto diretto con la pelle può provocare ustioni o dermatiti. Quando si lavora con questo composto è necessario utilizzare misure protettive adeguate come guanti, occhiali e protezione respiratoria. È importante evitare di inalarne i vapori o le polveri perché possono irritare le vie respiratorie. L’anidride butenedioica deve essere conservata in un’area fresca e ben ventilata, lontano da sostanze incompatibili. Una corretta manipolazione e il rispetto dei protocolli di sicurezza sono essenziali per ridurre al minimo i rischi associati a questa sostanza chimica.
| Simboli di pericolo | XI |
| Descrizione della sicurezza | Irritante |
| Numeri di identificazione delle Nazioni Unite | UN2215 |
| Codice SA | 2917.12.000 |
| Classe di pericolo | 8 (Corrosivo) |
| Gruppo di imballaggio | III |
| Tossicità | Nocivo se ingerito o inalato, provoca irritazione |
Metodi per la sintesi dell’anidride maleica
Vari metodi possono sintetizzare l’anidride butenedioica. Un metodo comune consiste nell’ossidare cataliticamente il benzene facendolo reagire con aria o ossigeno in presenza di un catalizzatore adatto, come pentossido di vanadio o un ossido di metallo. La reazione avviene a temperature elevate, tipicamente intorno ai 300-400 gradi Celsius, e produce anidride butenedioica.
Un altro metodo consiste nell’ossidare cataliticamente il butano o l’n-butano. Questo processo utilizza catalizzatori come catalizzatori al vanadio o molibdeno ad alte temperature. Ciò comporta diverse fasi di reazione, inclusa la formazione di acido butenedioico come intermedio, che subisce disidratazione per dare anidride butenedioica.
La reazione dell’acido butenedioico con l’anidride acetica è un altro metodo. In questo caso, l’acido butenedioico reagisce con l’anidride acetica in presenza di un catalizzatore come l’acido solforico . La reazione avviene in condizioni di riflusso, determinando la produzione di anidride butenedioica come prodotto finale.
Inoltre, l’ossidazione catalitica di idrocarburi come n-butene o derivati del benzene come ortoxilene o metaxilene consente la sintesi dell’anidride butenedioica. Queste reazioni utilizzano condizioni e catalizzatori simili menzionati in precedenza.
La scelta del metodo di sintesi appropriato dipende da fattori quali la disponibilità delle materie prime, la scala di produzione desiderata e l’economia del processo. Ciascun metodo presenta vantaggi e limiti in termini di costi, prestazioni e considerazioni ambientali. Pertanto, la selezione del metodo di sintesi appropriato è fondamentale per produrre in modo efficiente l’anidride butenedioica.
Usi dell’anidride maleica
L’anidride maleica trova molte applicazioni in vari settori grazie alle sue proprietà versatili. Ecco alcuni usi chiave:
- L’anidride butenedioica svolge un ruolo cruciale nella produzione di polimeri come il polibutilene succinato (PBS), resine poliestere insature e resine alchidiche. Questi polimeri trovano applicazioni in rivestimenti, adesivi e materiali compositi.
- Aiuta a creare erbicidi e pesticidi, agendo come intermedio nella sintesi di agenti efficaci per il controllo delle infestanti come il dicamba e l’idrazide butenedioica.
- L’industria farmaceutica lo utilizza nella sintesi di vari intermedi farmaceutici e principi attivi, contribuendo allo sviluppo di farmaci per il trattamento dell’ipertensione, dell’infiammazione e del cancro.
- I polimeri di anidride butenedioica fungono attivamente da inibitori di incrostazione e corrosione nei processi di trattamento dell’acqua, controllando attivamente l’accumulo di depositi minerali e proteggendo attivamente le infrastrutture.
- Trova il suo utilizzo nella produzione di collanti per l’industria della carta e del cartone, migliorando la resistenza all’acqua, la stampabilità e la resistenza della carta.
- L’industria tessile lo utilizza per produrre ausiliari tessili, inclusi coloranti, fissatori di coloranti e agenti di finitura, migliorando la solidità del colore e le prestazioni del tessuto.
- I derivati dell’anidride butenedioica servono come additivi alimentari, funzionando come agenti gelificanti, stabilizzanti o acidificanti in vari prodotti alimentari.
- Svolgono attivamente un ruolo nella produzione di additivi lubrificanti che migliorano attivamente le prestazioni e la longevità degli oli lubrificanti, migliorando così attivamente la loro efficacia complessiva.
L’ampia gamma di applicazioni evidenzia l’importanza dell’anidride butenedioica in vari settori, rendendola un composto prezioso nei processi industriali e nello sviluppo di prodotti.
Domande:
D: Qual è il prodotto dell’anidride maleica e dell’e-2 4-esadien-1-olo?
R: Il prodotto è un addotto Diels-Alder, in particolare cis-N-etil-3-metil-4-fenilsuccinimide.
D: Qual è il ruolo dell’anidride maleica nella reazione di Diels-Alder?
A: L’anidride butenedioica agisce come un dienofilo, reagendo con i dieni per formare addotti ciclici.
D: L’anidride maleica danneggia gli organismi acquatici?
R: Sì, l’anidride butenedioica può essere dannosa per gli organismi acquatici a causa della sua tossicità e dei potenziali effetti avversi.
D: Se si utilizzano antracene e anidride maleica, qual è la massa molare del prodotto?
R: La massa molare del prodotto formato da antracene e anidride butenedioica dipende dalla reazione specifica e dall’addotto risultante.
D: L’anidride maleica è aromatica?
R: Sì, l’anidride butenedioica è considerata aromatica a causa della presenza di un sistema coniugato ciclico.
D: Perché i flaconi di anidride maleica devono essere chiusi ermeticamente quando non vengono utilizzati?
R: L’anidride butenedioica è molto reattiva e può facilmente subire reazioni avverse con l’umidità e l’aria. Mantenere le bottiglie ben chiuse aiuta a evitare reazioni indesiderate e preserva la qualità.
D: L’anidride maleica è polare?
R: Sì, l’anidride butenedioica è polare a causa della presenza di gruppi funzionali polari, come i gruppi carbonilici, nella sua struttura.
D: L’anidride maleica è un dienofilo?
R: Sì, l’anidride butenedioica agisce come dienofilo nelle reazioni di Diels-Alder, accettando dieni per formare cicloaddotti.
D: Quale diene pensi che reagirebbe più rapidamente con l’anidride maleica?
R: I dieni con maggiore densità elettronica, come quelli contenenti sostituenti donatori di elettroni, dovrebbero reagire più rapidamente con l’anidride butenedioica.
D: Quanti esteri ci sono nell’anidride maleica?
R: L’anidride butenedioica non contiene esteri. È un’anidride dell’acido butenedioico, che contiene funzionalità estere.
