Cos’è l’ammoniaca?
L’ammoniaca o NH3 è un gas incolore e pungente composto da azoto e idrogeno, ampiamente utilizzato nell’industria come refrigerante, detergente e fertilizzante.
| Nome IUPAC | Ammoniaca |
| Formula molecolare | NH3 |
| numero CAS | 7664-41-7 |
| Sinonimi | Azane, triidruro di azoto, alcol Hartshorn |
| InChI | InChI=1S/NH3/c1-2 |
Proprietà dell’ammoniaca
Struttura di Lewis per l’ammoniaca
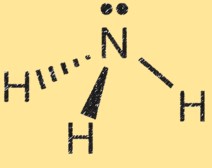
La struttura di Lewis dell’ammoniaca (NH3) mostra la disposizione degli elettroni nella molecola. In una struttura di Lewis, i punti rappresentano gli elettroni e le linee rappresentano i legami tra gli atomi.
La struttura di Lewis dell’ammoniaca mostra l’atomo di azoto circondato da tre atomi di idrogeno e una coppia di elettroni condivisi tra gli atomi di azoto e idrogeno. Questo rappresenta i legami covalenti nella molecola. L’atomo di azoto ha cinque elettroni di valenza e gli atomi di idrogeno hanno ciascuno un elettrone di valenza. Nella struttura di Lewis dell’ammoniaca, l’atomo di azoto forma tre legami singoli con gli atomi di idrogeno e ha una coppia di elettroni non condivisa.
Formula di ammoniaca
La formula chimica dell’ammoniaca è NH3. La formula indica che ci sono tre atomi di idrogeno e un atomo di azoto in ciascuna molecola di ammoniaca. La formula rappresenta la composizione della sostanza e fornisce importanti informazioni sulle sue proprietà e sul suo comportamento.
NH3 Massa molare
La massa molare di una sostanza è la massa di una mole della sostanza ed è espressa in grammi per mole. La massa molare dell’ammoniaca (NH3) è 17,0307 g/mol. Ciò significa che una mole di ammoniaca ha una massa di 17,0307 grammi. La massa molare di una sostanza è importante per determinare il numero di moli in un dato campione e può essere utilizzata per determinare la massa formula di un composto.
Punto di ebollizione dell’ammoniaca
NH3 ha un punto di ebollizione di -33,34°C (-28,012°F). Il punto di ebollizione di una sostanza è la temperatura alla quale la sua pressione di vapore eguaglia la pressione atmosferica e inizia a trasformarsi da liquido a gas. Il punto di ebollizione dell’NH3 è relativamente basso rispetto ad altri prodotti chimici, rendendolo un refrigerante utile nei sistemi di raffreddamento e refrigerazione.
Punto di fusione dell’NH3
NH3 ha un punto di fusione di -77,73°C (-107,87°F). Il punto di fusione di una sostanza è la temperatura alla quale essa passa dallo stato solido a quello liquido. Il basso punto di fusione dell’NH3 lo rende un refrigerante utile, poiché può essere facilmente condensato da gas a liquido, consentendogli di assorbire calore quando cambia stato.
NH3 Densità g/ml
La densità di una sostanza è la massa di un campione per unità di volume. La densità di NH3 è 0,769 g/mL. Ciò significa che un millilitro di NH3 ha una massa di 0,769 grammi. La densità di una sostanza può essere utilizzata per determinare la quantità di materia presente in un dato volume ed è una proprietà importante per comprendere come si comporta una sostanza nei diversi stati.
Peso molecolare dell’NH3
Il peso molecolare di una sostanza è la somma dei pesi atomici di tutti gli atomi presenti in una singola molecola della sostanza. Il peso molecolare di NH3 (NH3) è 17,0307 g/mol. Ciò significa che una molecola di NH3 ha un peso molecolare di 17,0307 grammi per mole. Il peso molecolare di una sostanza è importante per determinare il numero di moli in un dato campione e può essere utilizzato per determinare la massa formula di un composto.
Struttura NH3
NH3 è una molecola composta da tre atomi di idrogeno e un atomo di azoto. L’atomo di azoto è legato agli atomi di idrogeno tramite un legame covalente e la molecola ha una forma piramidale trigonale. Gli angoli di legame nella molecola sono circa 107°. NH3 è una molecola polare, il che significa che ha un’estremità positiva e una negativa, ed è comunemente usata come solvente e reagente nelle reazioni chimiche.
| Aspetto | Gas incolore |
| Peso specifico | 0,59 (aria = 1) |
| Colore | Incolore |
| Odore | Odore pungente e forte |
| Massa molare | 17,0307 g/mole |
| Densità | 0,769 g/ml |
| Punto di fusione | -77,73°C |
| Punto di ebollizione | -33,34°C |
| Punto flash | Non applicabile (gas) |
| solubilità in acqua | Molto solubile |
| Solubilità | Solubile in acqua e nella maggior parte dei solventi organici |
| Pressione del vapore | 50,7 kPa a 20°C |
| Densità del vapore | 0,59 (aria = 1) |
| pKa | 4,75 |
| pH | 11.6 (soluzione satura) |
Sicurezza e pericoli dell’ammoniaca
L’NH3 è un gas altamente tossico e corrosivo che può danneggiare gravemente la salute umana e l’ambiente se non gestito correttamente. L’NH3 può causare gravi ustioni agli occhi, alla pelle e al tratto respiratorio e può anche essere fatale se inalato in concentrazioni elevate. Inoltre, l’NH3 è molto reattivo e può accendersi o esplodere se entra in contatto con determinati prodotti chimici o materiali.
È importante prendere precauzioni di sicurezza quando si maneggia o si lavora con NH3. Ciò include indossare indumenti protettivi, come guanti, occhiali e una maschera facciale, oltre a fornire un’adeguata ventilazione per evitare di inalare il gas. È inoltre importante conservare l’NH3 in aree ben ventilate, lontano da fonti di calore e altri materiali infiammabili. Se esposto a NH3, è importante rimuovere gli indumenti contaminati e sciacquare l’area interessata con abbondante acqua. Rivolgersi immediatamente al medico se compaiono sintomi di esposizione.
| Simboli di pericolo | T+, n |
| Descrizione della sicurezza | Pericoloso per l’ambiente, nocivo per inalazione, irritante |
| Identificatori AN | ONU 1005 |
| Codice SA | 2814.1 |
| Classe di pericolo | 2.3 |
| Gruppo di imballaggio | II |
| Tossicità | Dose altamente tossica e mortale (inalazione) – 33-66 ppm |
Metodi di sintesi dell’ammoniaca
Esistono diversi metodi per sintetizzare l’ammoniaca, tra cui il processo Haber, il processo Ostwald e il processo Birkeland-Eyde.
Il processo Haber, noto anche come processo Haber-Bosch, è il metodo più utilizzato per la sintesi industriale dell’ammoniaca. In questo processo, l’azoto presente nell’aria reagisce con l’idrogeno gassoso su un catalizzatore di ferro per formare ammoniaca. La reazione avviene ad alta pressione (circa 150 atmosfere) e ad una temperatura di 450-500°C. Il processo Haber è molto efficiente, produce grandi quantità di ammoniaca ad alto rendimento e viene utilizzato come fonte primaria di ammoniaca per la produzione di fertilizzanti e altri prodotti chimici.
Il processo Ostwald, noto anche come processo di fissazione dell’azoto, è un metodo più antico di sintesi dell’ammoniaca che prevede l’ossidazione del gas azoto in ossido nitrico, seguita dalla reazione dell’ossido nitrico con più gas azoto per formare ammoniaca. Questo processo è meno efficiente ed è stato in gran parte sostituito dal processo Haber.
Il processo Birkeland-Eyde, noto anche come processo al plasma, è un metodo più recente di sintesi dell’ammoniaca che utilizza una scarica di plasma per dissociare i gas di azoto e idrogeno e formare ammoniaca. Questo processo è ancora in fase di sviluppo e non è stato ampiamente adottato per uso industriale.
In sintesi, il processo Haber è il metodo più comunemente utilizzato per la sintesi dell’ammoniaca, mentre il processo Ostwald e il processo Birkeland-Eyde sono metodi più vecchi o meno utilizzati.
Usi dell’ammoniaca
L’ammoniaca è una sostanza chimica versatile che ha una vasta gamma di usi nell’industria e nell’agricoltura. Alcuni degli usi principali dell’ammoniaca includono:
- Produzione di fertilizzanti: l’ingrediente principale nella produzione di fertilizzanti azotati, l’ammoniaca aumenta i raccolti e migliora la fertilità del suolo.
- Refrigerazione: i sistemi di refrigerazione industriale e domestica utilizzano l’ammoniaca come refrigerante, compresi frigoriferi e congelatori.
- Pulizia: i prodotti per la pulizia della casa spesso contengono ammoniaca a causa della sua capacità di sciogliere grasso e sporco.
- Prodotti farmaceutici: la produzione di vari prodotti farmaceutici, come antiacidi e sciroppi per la tosse, utilizza l’ammoniaca come materia prima.
- Produzione tessile: la tintura e la stampa dei tessuti, nonché la produzione di fibre sintetiche, utilizzano ammoniaca.
- Trattamento dei rifiuti: il trattamento delle acque reflue e il controllo degli odori provenienti dagli impianti di trattamento delle acque reflue comportano l’uso di ammoniaca.
- Ritardanti di fiamma: l’ammoniaca agisce come ritardante di fiamma nella produzione di materiali come plastica, gomma e altri.
- Produzione di petrolio e gas: l’industria del petrolio e del gas utilizza l’ammoniaca per produrre vari prodotti chimici, inclusi tensioattivi e demulsionanti.
In conclusione, l’ammoniaca è una sostanza chimica versatile che ha un’ampia gamma di usi in vari settori e applicazioni, tra cui agricoltura, refrigerazione, pulizia, prodotti farmaceutici, produzione tessile, trattamento dei rifiuti, ritardanti di fiamma e produzione di petrolio e gas.
Domande:
L’ammoniaca è un acido o una base?
L’ammoniaca è considerata una base. Nelle soluzioni acquose si dissolve per formare ioni idrossido (OH-) e agisce come una base debole. L’ammoniaca ha un pH basico (alcalino), solitamente intorno a 11. Le soluzioni di ammoniaca possono neutralizzare gli acidi per formare sale e acqua, che è una delle caratteristiche distintive di una base. Nelle reazioni chimiche, l’ammoniaca può anche agire come nucleofilo e partecipare a reazioni che formano ammidi, che sono derivati dell’ammoniaca e contengono il legame azoto-carbonio caratteristico delle ammine e delle ammidi.
L’ammoniaca è polare?
Sì, l’ammoniaca è polare. Ha una geometria molecolare curva con un atomo di azoto centrale circondato da tre atomi di idrogeno. Questa forma crea un momento dipolare permanente, con l’estremità positiva del dipolo situata negli atomi di idrogeno e l’estremità negativa situata nell’atomo di azoto. La natura polare dell’ammoniaca le consente di dissolversi in solventi polari come l’acqua, che è una caratteristica delle molecole polari. La natura polare dell’ammoniaca le consente anche di partecipare al legame idrogeno, che è un tipo di forza intermolecolare che si verifica tra molecole polari. Questo legame idrogeno può portare a punti di ebollizione e fusione più elevati rispetto alle molecole non polari di dimensioni simili.
