Il cloruro di alluminio o AlCl3 è un composto chimico utilizzato in vari processi industriali. Agisce come un acido di Lewis, catalizzando la sintesi organica e le reazioni di polimerizzazione. Ha anche proprietà antitraspiranti nei prodotti per la cura personale.
| Nome IUPAC | Tricloruro di alluminio |
| Formula molecolare | AlCl3 |
| numero CAS | 7446-70-0 |
| Sinonimi | Tricloruro di alluminio, cloruro di alluminio (III), cloruro di alluminio (III), cloruro di alluminio, tricloroalluminio |
| InChI | InChI=1S/3ClH.Al/h3*1H;/q;;;+3/p-3 |
Formula del cloruro di alluminio
La formula chimica del cloruro di alluminio è AlCl3. Questa formula rappresenta il numero di atomi di ciascun elemento nella molecola. La formula del cloruro di alluminio è importante perché viene utilizzata per identificare la sostanza e calcolarne le proprietà. La formula viene utilizzata anche nelle equazioni chimiche per rappresentare i reagenti e i prodotti di una reazione chimica.
Massa molare del cloruro di alluminio
Il cloruro di alluminio ha una massa molare di 133,34 g/mol. Questo valore viene calcolato sommando la massa atomica di un atomo di alluminio e tre atomi di cloro. La formula molecolare del cloruro di alluminio è AlCl3, il che significa che contiene un atomo di alluminio e tre atomi di cloro. La massa molare è una proprietà importante del cloruro di alluminio perché viene utilizzata in molte reazioni chimiche e processi industriali. La massa molare viene utilizzata anche per calcolare la quantità di una sostanza presente in un dato campione.
Punto di ebollizione del cloruro di alluminio
Il punto di ebollizione del cloruro di alluminio è 180,8°C (357,4°F). Questo valore è la temperatura alla quale la forma liquida del cloruro di alluminio passa allo stato gassoso. Il punto di ebollizione del cloruro di alluminio è relativamente alto, rendendolo utile in molti processi industriali che richiedono temperature elevate. Ad esempio, il cloruro di alluminio viene utilizzato come catalizzatore nella produzione del polipropilene, un polimero termoplastico.
Punto di fusione del cloruro di alluminio
Il punto di fusione del cloruro di alluminio è 194°C (381,2°F). Questo valore è la temperatura alla quale la forma solida del cloruro di alluminio passa allo stato liquido. Il punto di fusione del cloruro di alluminio è relativamente basso, il che significa che può essere facilmente fuso e utilizzato in varie reazioni chimiche e processi industriali. Ad esempio, il cloruro di alluminio viene utilizzato come coagulante nell’industria del trattamento delle acque.
Densità del cloruro di alluminio g/ml
La densità del cloruro di alluminio è 2,44 g/cm3. Questo valore è la massa di cloruro di alluminio per unità di volume. La densità del cloruro di alluminio è importante perché determina la massa di un dato volume della sostanza. La densità del cloruro di alluminio viene utilizzata anche per calcolare la concentrazione della sostanza in una soluzione.
Struttura in cloruro di alluminio
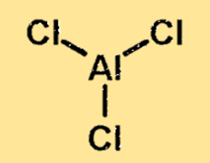
La struttura del cloruro di alluminio è una molecola legata in modo covalente con un atomo di alluminio e tre atomi di cloro. L’atomo di alluminio si trova al centro della molecola, circondato dai tre atomi di cloro. La struttura del cloruro di alluminio è importante perché determina le proprietà fisiche e chimiche della sostanza.
Peso molecolare del cloruro di alluminio
Il peso molecolare del cloruro di alluminio è 133,34 g/mol. Questo valore è la somma dei pesi atomici degli atomi nella molecola. Il peso molecolare del cloruro di alluminio è importante perché viene utilizzato per calcolare la quantità di una sostanza presente in un dato campione. Questo valore viene utilizzato anche per determinare la concentrazione molare di una soluzione.
| Aspetto | Solido o polvere da bianco a giallo |
| Peso specifico | 2,44 g/cm3 |
| Colore | Da incolore a giallo pallido |
| Odore | Inodore |
| Massa molare | 133,34 g/mole |
| Densità | 2,44 g/cm3 |
| Punto di fusione | 194°C (381,2°F) |
| Punto di ebollizione | 180,8°C (357,4°F) |
| Punto flash | Non applicabile |
| solubilità in acqua | Molto solubile in acqua |
| Solubilità | Solubile in etanolo, metanolo ed etere |
| Pressione del vapore | 2,67 kPa a 25°C |
| Densità del vapore | 4.45 (aria = 1) |
| pKa | -6 |
| pH | 2,0 (10 g/L, H2O) |
Sicurezza e pericoli del cloruro di alluminio
Il cloruro di alluminio comporta numerosi rischi per la sicurezza e la salute. È corrosivo e può causare grave irritazione alla pelle e agli occhi, nonché irritazione del tratto respiratorio e digestivo se ingerito o inalato. Può anche provocare ustioni se entra in contatto con la pelle. Il cloruro di alluminio è un forte agente ossidante e può reagire violentemente con l’acqua, liberando gas di acido cloridrico. È inoltre incompatibile con molti composti organici, come alcoli e ammine, e può reagire con essi producendo gas pericolosi. Quando si maneggia il cloruro di alluminio è necessario indossare dispositivi di protezione adeguati, inclusi guanti, occhiali e un respiratore.
| Simboli di pericolo | Corrosivo, nocivo |
| Descrizione della sicurezza | Evitare il contatto con la pelle e gli occhi. Indossare guanti protettivi e proteggere gli occhi/il viso. In caso di contatto sciacquare abbondantemente con acqua e consultare un medico. Non ingerire o inalare. Utilizzare in un’area ben ventilata. Conservare in un luogo fresco e asciutto, lontano da materiali incompatibili. |
| Numeri di identificazione delle Nazioni Unite | ONU 1726 |
| Codice SA | 2827.32.00 |
| Classe di pericolo | 8 |
| Gruppo di imballaggio | III |
| Tossicità | Tossico se ingerito o inalato. Provoca grave irritazione della pelle e degli occhi. Può causare irritazione delle vie respiratorie e digestive. Può reagire violentemente con l’acqua, liberando gas di acido cloridrico. Incompatibile con molti composti organici, come alcoli e ammine, e può reagire con essi producendo gas pericolosi. |
Metodi per la sintesi del cloruro di alluminio
Il cloruro di alluminio può essere sintetizzato con vari metodi come la sintesi diretta, l’idrolisi e la reazione dell’alluminio con acido cloridrico.
- La sintesi diretta prevede la reazione dell’alluminio con il cloro gassoso ad alte temperature, solitamente intorno ai 700-800°C. La reazione dell’alluminio con l’acido cloridrico genera cloruro di alluminio in fase gassosa, che può essere condensato in forma liquida.
- L’idrolisi prevede la reazione dell’alluminio metallico con acido cloridrico o acqua, che produce idrogeno gassoso e cloruro di alluminio. La reazione di idrolisi è generalmente esotermica e può essere pericolosa se non condotta correttamente.
- La reazione dell’alluminio con acido cloridrico gassoso è un altro metodo per sintetizzare il cloruro di alluminio. Questa reazione avviene a temperatura ambiente e produce gas idrogeno e cloruro di alluminio.
- Un altro metodo comune per sintetizzare il cloruro di alluminio consiste nel far reagire l’ossido di alluminio con l’acido cloridrico. Questa reazione produce cloruro di alluminio e acqua come prodotti.
- La reazione dell’alluminio con una miscela di cloro gassoso e monossido di carbonio è un altro metodo per sintetizzare il cloruro di alluminio. Questa reazione avviene ad alte temperature e produce cloruro di alluminio e anidride carbonica.
Nel complesso, la sintesi del cloruro di alluminio richiede un’attenta gestione e controllo delle condizioni di reazione per garantire un processo sicuro ed efficiente.
Usi del cloruro di alluminio
Il cloruro di alluminio ha molti usi in vari settori grazie alle sue proprietà uniche.
- Le reazioni di chimica organica, inclusa la produzione di polimeri, prodotti farmaceutici e profumi, utilizzano comunemente il cloruro di alluminio come catalizzatore.
- Il trattamento dell’acqua potabile e delle acque reflue per rimuovere i solidi sospesi spesso comporta l’uso del cloruro di alluminio come coagulante.
- La produzione di alluminio e leghe trae vantaggio dall’uso del cloruro di alluminio come flusso, che aiuta a rimuovere le impurità e migliorare il processo di fusione.
- Nell’industria petrolchimica, il cloruro di alluminio funge da catalizzatore nella produzione di benzina e altri idrocarburi. Inoltre, viene utilizzato come deodorante e antitraspirante nei prodotti per la cura personale.
- Alcuni farmaci da banco utilizzano il cloruro di alluminio, che ha proprietà astringenti, per trattare piccole irritazioni cutanee e fermare il sanguinamento. Il cloruro di alluminio viene utilizzato anche per trattare l’iperidrosi, una condizione caratterizzata da sudorazione eccessiva.
- L’industria tessile utilizza il cloruro di alluminio come mordente per aiutare a fissare i coloranti ai tessuti e viene utilizzato anche nella produzione di gomma sintetica.
Nel complesso, il cloruro di alluminio trova usi diversi e importanti in molti settori, evidenziando la sua importanza nel mondo moderno.
Domande:
D: Quale è il miglior confronto tra 1 mole di cloruro di sodio e 1 mole di cloruro di alluminio?
R: 1 mole di cloruro di sodio (NaCl) e 1 mole di cloruro di alluminio (AlCl3) contengono entrambe 1 mole di ioni cloruro, ma il cloruro di alluminio contiene tre volte più cationi del cloruro di sodio.
D: Il cloruro di alluminio è acquoso?
R: Il cloruro di alluminio può esistere in forma solida e acquosa. Quando disciolto in acqua forma una soluzione molto acida a causa dell’idrolisi del catione alluminio.
D: Qual è la formula corretta per il cloruro di alluminio?
R: La formula corretta per il cloruro di alluminio è AlCl3. Ciò indica che ciascuna molecola di cloruro di alluminio contiene un catione di alluminio (Al3+) e tre anioni cloruro (Cl-).
D: Il cloruro di alluminio è sicuro?
R: Il cloruro di alluminio può essere pericoloso se non maneggiato correttamente. Può causare irritazione alla pelle e agli occhi, irritazione del tratto respiratorio e digestivo e può essere tossico se ingerito o inalato. Dovrebbe essere immagazzinato e maneggiato in un’area ben ventilata e con dispositivi di protezione adeguati.
D: Quanti ioni cloruro ci sono in 1,50 moli di cloruro di alluminio?
R: Poiché la formula del cloruro di alluminio è AlCl3, ogni molecola contiene tre ioni cloruro. Pertanto, 1,50 moli di cloruro di alluminio contengono 1,50 x 3 = 4,50 moli di ioni cloruro.
