L’acido solforico (H2SO4) o olio di vetriolo è un acido minerale forte e altamente corrosivo comunemente utilizzato in vari processi industriali come la produzione di fertilizzanti, la raffinazione del petrolio e la lavorazione dei metalli. È anche un potente agente disidratante.
| Nome IUPAC | Acido solforico |
| Formula molecolare | H2SO4 |
| numero CAS | 7664-93-9 |
| Sinonimi | Olio di vetriolo, anidride dell’acido solforico, acido bisolforico |
| InChI | InChI=1S/H2O4S/c2-1(3)4/h(H2,2,3,4)/p-1 |
Proprietà dell’acido solforico
Formula dell’acido solforico
La formula chimica dell’acido solforico è H2SO4, che rappresenta due atomi di idrogeno, un atomo di zolfo e quattro atomi di ossigeno. Questa formula rappresenta la composizione della molecola di acido solforico e la sua struttura chimica.
Massa molare dell’acido solforico
La massa molare dell’acido solforico è 98,08 g/mol. Si calcola aggiungendo le masse atomiche di ciascun elemento nella formula chimica dell’acido solforico (H2SO4).
Punto di ebollizione dell’acido solforico
L’acido solforico ha un punto di ebollizione di 337,1°C. A questa temperatura la pressione del vapore del liquido raggiunge la pressione atmosferica e inizia a bollire.
Punto di fusione dell’acido solforico
Il punto di fusione dell’acido solforico è 10,4°C. È un liquido molto viscoso a temperatura ambiente, ma può congelare fino a formare uno stato solido a temperature più basse.
Densità dell’acido solforico g/ml
La densità dell’acido solforico varia da 1,84 g/mL a 1,93 g/mL, a seconda della sua concentrazione. All’aumentare della concentrazione di acido solforico aumenta anche la sua densità.
Peso molecolare dell’acido solforico
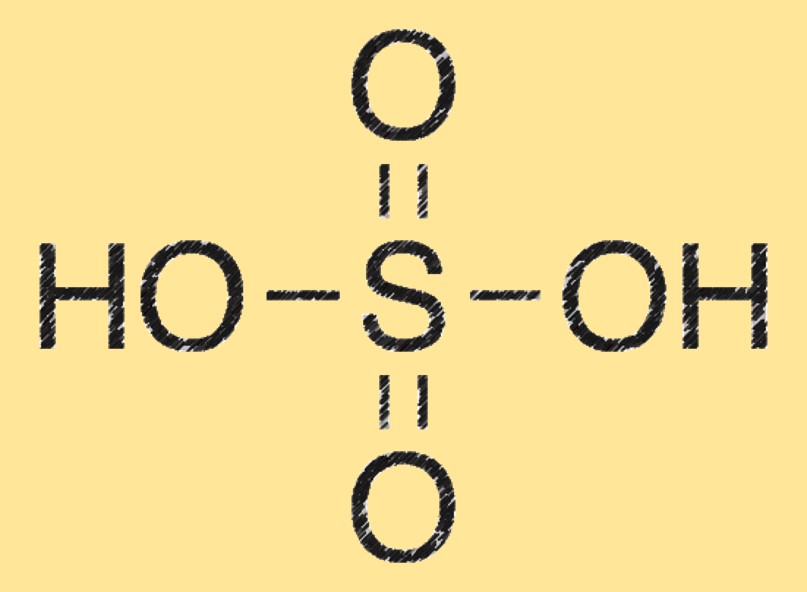
Il peso molecolare dell’acido solforico è 98,08 g/mol. Si calcola sommando le masse atomiche di ciascun elemento nella sua formula chimica (H2SO4).
Struttura dell’acido solforico
La molecola di acido solforico è costituita da due atomi di idrogeno (H) legati a un atomo di zolfo (S) legato anche a quattro atomi di ossigeno (O). Ha una geometria molecolare tetraedrica ed è un potente agente disidratante.
| Aspetto | Liquido limpido, incolore, oleoso |
| Peso specifico | 1,84 (acqua = 1) |
| Colore | Incolore |
| Odore | Odore pungente e sulfureo |
| Massa molare | 98,079 g/mole |
| Densità | 1.835 g/ml |
| Punto di fusione | 10,5°C |
| Punto di ebollizione | 337°C |
| Punto flash | 60°C (140°F) |
| solubilità in acqua | Completamente miscibile |
| Solubilità | Solubile in acqua e alcool |
| Pressione del vapore | 40 mmHg (20°C) |
| Densità del vapore | 2,5 (aria = 1) |
| pKa | -3 |
| pH | Meno di 1 (fortemente acido) |
Sicurezza e pericoli dell’acido solforico
L’acido solforico è una sostanza altamente corrosiva e pericolosa. Il contatto con la pelle e gli occhi può causare gravi ustioni e cecità. L’inalazione dei suoi vapori può irritare le vie respiratorie e provocare tosse, respiro sibilante e mancanza di respiro. È infiammabile e reattivo e deve essere maneggiato con cautela in un’area ben ventilata, utilizzando dispositivi di protezione come guanti e protezione per gli occhi. Le fuoriuscite devono essere pulite immediatamente per evitare di danneggiare le superfici e potenzialmente ferire le persone. Una corretta conservazione ed etichettatura sono necessarie per garantire una manipolazione sicura.
| Simboli di pericolo | Corrosivo, irritante, nocivo |
| Descrizione della sicurezza | Tenere lontano da fonti di calore/scintille/fiamme libere/superfici calde. Vietato fumare. Conservare in un’area ben ventilata. Tieni il contenitore chiuso ermeticamente. Indossare guanti/indumenti protettivi/proteggere gli occhi/il viso. |
| Numeri di identificazione delle Nazioni Unite | ONU1830 |
| Codice SA | 2815.11.00 |
| Classe di pericolo | 8 |
| Gruppo di imballaggio | II |
| Tossicità | Orale: LD50 = 1,2 g/kg (Ratto) |
Metodi per la sintesi dell’acido solforico
L’H2SO4 può essere sintetizzato con diversi metodi, incluso il processo di contatto e il processo della camera principale.
Il processo di contatto è il metodo più utilizzato per la produzione industriale di acido solforico, che prevede l’ossidazione dell’anidride solforosa in triossido di zolfo e quindi la reazione del triossido di zolfo con acqua per produrre H2SO4.
Il processo della camera di piombo, invece, prevede l’ossidazione del biossido di zolfo con biossido di azoto in presenza di un catalizzatore, solitamente biossido di piombo, e la successiva reazione del triossido di zolfo risultante con acqua. Entrambi i metodi producono H2SO4 con diversi livelli di purezza e concentrazione, che può essere ulteriormente purificato e concentrato secondo necessità.
Usi dell’acido solforico
H2SO4 è una sostanza chimica versatile e ampiamente utilizzata in vari settori. Le persone usano comunemente l’acido solforico nella produzione di fertilizzanti, detergenti, coloranti e pigmenti. Svolge anche un ruolo nella raffinazione dei prodotti petroliferi, nella lavorazione di minerali e minerali e nella produzione di sostanze chimiche come acido nitrico e solfati. I laboratori utilizzano H2SO4 come reagente e funge da catalizzatore nelle reazioni chimiche. Le batterie al piombo utilizzano l’acido solforico come elettrolita e i produttori di acciaio lo utilizzano per il decapaggio per rimuovere ruggine e incrostazioni prima della placcatura o della verniciatura.
Nel complesso, l’H2SO4 svolge un ruolo cruciale in molti processi industriali, rendendolo uno dei prodotti chimici più importanti al mondo.
Domande:
L’acido solforico è un acido forte?
Sì, H2SO4 è un acido forte. Un acido forte è un acido che si dissocia completamente in acqua per produrre ioni idrogeno (H+), il che significa che dona tutti i suoi ioni idrogeno alla soluzione. Considerato uno degli acidi più forti, l’acido solforico ha un elevato livello di acidità, che lo rende molto reattivo e corrosivo. Per evitare danni alle persone e all’ambiente, è essenziale una corretta manipolazione e conservazione dell’acido solforico.
A cosa serve l’acido solforico?
L’acido solforico è ampiamente utilizzato in vari settori e applicazioni. Alcuni degli usi più comuni di H2SO4 includono:
- Produzione di fertilizzanti: l’acido solforico viene utilizzato nella produzione di acido fosforico, che è un componente chiave di molti fertilizzanti.
- Raffinazione del petrolio: l’acido solforico viene utilizzato per rimuovere le impurità come i composti dello zolfo dal petrolio greggio durante il processo di raffinazione.
- Lavorazione dei metalli: l’acido solforico viene utilizzato nella lavorazione dei metalli per rimuovere ruggine e incrostazioni dal ferro e dall’acciaio, nonché per raffinare i minerali metallici.
- Produzione: l’acido solforico viene utilizzato nella produzione di una varietà di prodotti, inclusi detergenti, coloranti, pigmenti e altri prodotti chimici.
- Batterie per autoveicoli: l’acido solforico è utilizzato come elettrolita nelle batterie al piombo, comunemente utilizzate nelle automobili e in altri veicoli.
- Reagente di laboratorio: l’acido solforico è comunemente usato come reagente di laboratorio grazie al suo alto livello di reattività e alla sua capacità di dissolvere molte sostanze.
Che tipo di acido è l’acido solforico?
H2SO4 è un acido inorganico forte. Classificato come acido diprotico, H2SO4 dona due ioni idrogeno (H+) a una soluzione, rendendolo un acido minerale forte. A causa della sua natura altamente reattiva e corrosiva, è necessario prestare attenzione durante la manipolazione e lo stoccaggio di H2SO4 per evitare danni alle persone e all’ambiente. Le industrie utilizzano ampiamente l’acido solforico nei loro processi, inclusa la produzione di fertilizzanti, detergenti, coloranti, pigmenti e altri prodotti chimici, nonché nella raffinazione di prodotti petroliferi e nella lavorazione di minerali metallici.
Qual è la formula dell’acido solforico?
La formula chimica dell’acido solforico è H2SO4.
Cos’è l’olio di vetriolo?
L’olio di vetriolo è un altro termine per indicare l’acido solforico, una sostanza chimica potente e altamente corrosiva. È comunemente utilizzato nella produzione di fertilizzanti, detergenti e coloranti, nonché nella raffinazione del petrolio e nella lavorazione di altri prodotti chimici.
