L’acido propanoico o C3H6O2 è un acido carbossilico liquido incolore con un odore pungente. Viene utilizzato, tra l’altro, nella produzione di prodotti farmaceutici, erbicidi e conservanti alimentari.
| Nome IUPAC | Acido propanoico |
| Formula molecolare | C3H6O2 |
| numero CAS | 79-09-4 |
| Sinonimi | Acido propionico, acido metilacetico, acido etilformico, acido propanilformico, soluzione di acido propionico, ecc. |
| InChI | InChI=1S/C3H6O2/c1-2-3(4)5/h2H2.1H3,(H.4.5) |
Struttura dell’acido propanoico
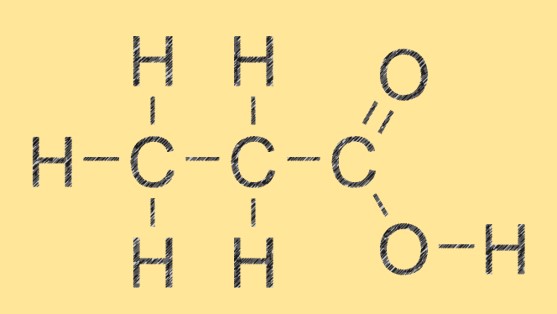
L’acido propanoico ha una struttura lineare semplice composta da tre atomi di carbonio, sei atomi di idrogeno e due atomi di ossigeno. Il gruppo dell’acido carbossilico (-COOH) è attaccato al secondo atomo di carbonio della molecola. Questa struttura consente all’acido propanoico di formare forti legami idrogeno con altre molecole di acido propanoico e con altri composti che hanno accettori o donatori di legami idrogeno.
Punto di ebollizione dell’acido propanoico
Il punto di ebollizione dell’acido propanoico è 141,1°C. Questo valore è influenzato dalle forze intermolecolari presenti nel composto. L’acido propanoico ha un punto di ebollizione relativamente alto rispetto ad altri acidi carbossilici semplici grazie alla sua capacità di formare forti legami idrogeno. Questa proprietà rende l’acido propanoico un solvente utile nella chimica organica.
Formula di acido propanoico
La formula chimica dell’acido propanoico è C3H6O2. Questa formula rappresenta il numero e il tipo esatto di atomi in una singola molecola di acido propanoico. La formula può essere utilizzata per calcolare la massa molare, il peso molecolare e i rapporti stechiometrici nelle reazioni chimiche che coinvolgono l’acido propanoico.
Massa molare dell’acido propionico
L’acido propionico ha una massa molare di 74,08 g/mol. È un acido carbossilico organico semplice con tre atomi di carbonio, sei atomi di idrogeno e due atomi di ossigeno. La massa molare è un parametro importante in chimica perché viene utilizzato per determinare la quantità di sostanza contenuta in un dato campione. Viene anche utilizzato nei calcoli stechiometrici per determinare la quantità di reagente o prodotto in una reazione chimica.
Punto di fusione dell’acido propionico
L’acido propionico ha un punto di fusione di -20,8°C. Questo basso punto di fusione è il risultato delle deboli forze intermolecolari presenti nel composto. L’acido propionico è liquido a temperatura ambiente e può facilmente solidificarsi a basse temperature.
Densità dell’acido propionico g/ml
L’acido propionico ha una densità di 0,99 g/mL a temperatura ambiente. Questa proprietà è influenzata dal peso molecolare e dalla densità di impaccamento delle molecole del composto. La densità dell’acido propionico lo rende meno denso dell’acqua, permettendogli di galleggiare sulla superficie dell’acqua.
Peso molecolare dell’acido propionico
Il peso molecolare dell’acido propionico è 74,08 g/mol. Questo valore viene calcolato sommando i pesi atomici degli atomi costituenti la molecola. Il peso molecolare dell’acido propionico viene utilizzato per determinare la massa molare e il numero di moli del composto in un dato campione.
| Aspetto | Liquido incolore |
| Peso specifico | 0,99 g/ml |
| Colore | Incolore |
| Odore | Acri |
| Massa molare | 74,08 g/mole |
| Densità | 0,99 g/ml |
| Punto di fusione | -20,8°C |
| Punto di ebollizione | 141,1°C |
| Punto flash | 60°C |
| solubilità in acqua | Miscibile |
| Solubilità | Solubile in etanolo, etere, acetone |
| Pressione del vapore | 1,5 mmHg a 25°C |
| Densità del vapore | 2,5 (contro aria) |
| pKa | 4.87 |
| pH | 2,8 (soluzione 1M) |
Nota: i valori forniti nella tabella sono approssimativi e possono variare a seconda dell’origine dati.
Acido propanoico Sicurezza e pericoli
La manipolazione impropria dell’acido propanoico può comportare rischi per la sicurezza e la salute. Questa sostanza è corrosiva e può causare gravi irritazioni alla pelle e agli occhi e problemi respiratori se inalata. Inoltre, l’acido propanoico è infiammabile e può formare miscele esplosive con l’aria. Per garantire la sicurezza, conservarlo in un’area fresca, asciutta e ben ventilata, lontano da fonti di calore, scintille o fiamme. Quando si maneggia questa sostanza, indossare dispositivi di protezione come guanti, occhiali e respiratori per evitare il contatto con la pelle e gli occhi o l’inalazione di vapori. Rivolgersi immediatamente al medico in caso di ingestione o di contatto con la pelle e gli occhi.
| Simboli di pericolo | Corrosivo (C) |
| Descrizione della sicurezza | S26-S36/37/39-S45 |
| Identificatori AN | Un 1848 |
| Codice SA | 2915.90.10 |
| Classe di pericolo | 8 (Materiale corrosivo) |
| Gruppo di imballaggio | III |
| Tossicità | LD50 (orale, ratto) = 1,26 g/kg |
Metodi di sintesi dell’acido propanoico
L’acido propionico può essere sintetizzato con diversi metodi. Un metodo comune è l’ossidazione del propilene, che prevede la reazione del propilene con l’aria in presenza di un catalizzatore, solitamente un ossido metallico, per formare acroleina. L’acroleina viene quindi ossidata per formare acido acrilico, che viene poi convertito in acido propionico attraverso una reazione di decarbossilazione.
Un altro metodo prevede la carbossilazione dell’etilene, che prevede la reazione dell’etilene con anidride carbonica e acqua in presenza di un catalizzatore, solitamente un sale metallico o un complesso di palladio, per formare etilene. acetaldeide. L’acetaldeide viene quindi ossidata ad acido acetico, che viene poi convertito in acido propanoico attraverso una reazione di decarbossilazione.
Un terzo metodo prevede l’idrolisi del cianuro di etile, che prevede la reazione del cianuro di etile con acqua in presenza di un acido o una base forte per formare acido propionico.
Un quarto metodo prevede la fermentazione dei carboidrati, che prevede l’utilizzo di batteri come il Propionibacterium freudenreichii per convertire gli zuccheri in acido propionico. Questo metodo è comunemente utilizzato nell’industria alimentare per produrre acido propionico da utilizzare come conservante.
Nel complesso, questi metodi forniscono varie opzioni per la sintesi dell’acido propionico, a seconda della purezza, della resa e dell’impatto ambientale desiderati.
Usi dell’acido propanoico
- L’industria alimentare utilizza l’acido propanoico come conservante per prevenire la crescita di batteri e muffe nei prodotti da forno, nei latticini e negli alimenti per animali domestici.
- L’acido propionico funge da intermedio chimico nella produzione di altri prodotti chimici, compresi gli esteri utilizzati nella produzione di profumi, aromi e materie plastiche.
- L’anidride propionica, prodotta dall’acido propanoico, viene utilizzata come solvente e reagente nella sintesi organica.
- L’industria farmaceutica utilizza l’acido propanoico come materia prima nella sintesi di farmaci come l’ibuprofene, il naprossene e il fenoprofene.
- L’acido propionico viene utilizzato anche nella produzione di erbicidi e insetticidi.
- L’acetato propionato di cellulosa, un rivestimento per prodotti farmaceutici e un componente di pitture, vernici e rivestimenti, è prodotto dall’acido propionico.
Nel complesso, l’acido propionico ha un’ampia gamma di applicazioni grazie alle sue proprietà antibatteriche e conservanti, nonché alla sua versatilità come intermedio chimico.
Domande:
Si può prevedere quale composto abbia proprietà chimiche simili a quelle dell’acido propanoico (ch3ch2cooh)?
L’acido propionico (CH3CH2COOH) prevede che i composti con una struttura chimica simile avranno proprietà chimiche comparabili. L’acido butanoico (CH3CH2CH2COOH) è un composto con struttura simile all’acido propionico, con l’aggiunta di un gruppo metilenico nella catena del carbonio. Si prevede che questo gruppo metilenico in più influisca sulla polarità e sull’acidità della molecola, ma entrambi i composti hanno caratteristiche analoghe, come ad esempio essere acidi organici deboli.
L’industria alimentare utilizza l’acido butanoico come conservante e funge da intermedio chimico nella produzione di esteri, solventi e prodotti farmaceutici, simili all’acido propanoico. L’acido butanoico può anche sostituire l’acido propionico in alcune applicazioni perché ha un valore pKa vicino.
L’acido propanoico è un acido forte?
L’acido propanoico è un acido debole. Il suo pKa è circa 4,87, il che indica che non cede facilmente un protone a una base in una reazione chimica.
In confronto, gli acidi forti come l’acido cloridrico (HCl) e l’acido solforico (H2SO4) hanno valori pKa molto più bassi e donano facilmente protoni nelle reazioni chimiche. Sebbene sia un acido debole, l’acido propionico è comunque utile in alcune applicazioni. La sua bassa acidità lo rende adatto come conservante nell’industria alimentare, poiché è efficace nell’inibire la crescita di batteri e funghi senza alterare il gusto o l’odore dei prodotti alimentari.
