L’acido ossalico è un composto organico incolore e inodore presente in molte verdure e frutta. Viene utilizzato in vari processi industriali come la pulizia e lucidatura dei metalli. Può anche essere dannoso se ingerito in grandi quantità.
| Nome IUPAC | Acido etandioico |
| Formula molecolare | C2H2O4 |
| numero CAS | 144-62-7 |
| Sinonimi | Acido etandioico, acido zuccherino, acido ossirico, candeggina per legno, acido acetosa, acido C2dicarbossilico, ecc. |
| InChI | InChI=1S/C2H2O4/c3-1(4)2(5)6/h(H,3.4)(H,5.6) |
Proprietà dell’acido ossalico
Formula dell’acido ossalico
La formula chimica dell’acido ossalico è C2H2O4. È costituito da due atomi di carbonio, due atomi di ossigeno e quattro atomi di idrogeno. La formula dell’acido ossalico è importante in molti calcoli chimici, come la determinazione del peso molecolare o del numero di moli di acido ossalico in un campione. La formula fornisce anche informazioni sul rapporto degli atomi presenti nella molecola.
Massa molare dell’acido ossalico
La massa molare dell’acido etandioico è 90,03 g/mol. Questo si calcola sommando le masse atomiche di ciascun elemento presente nella molecola (2 atomi di carbonio, 2 atomi di ossigeno e 4 atomi di idrogeno). La massa molare dell’acido etandioico è importante in molti calcoli chimici, come determinare la quantità di acido etandioico necessaria per una reazione specifica o la concentrazione di una soluzione di acido etandioico.
Punto di ebollizione dell’acido ossalico
Il punto di ebollizione dell’acido etandioico è 365°C. A questa temperatura, la fase liquida dell’acido etandioico si trasforma nella fase vapore e diventa gassosa. Il punto di ebollizione dell’acido etandioico è influenzato da vari fattori quali pressione, purezza e presenza di impurità. L’acido ossalico è relativamente stabile alle alte temperature, ma l’esposizione prolungata al calore può provocarne la decomposizione e la produzione di anidride carbonica e acqua.
Punto di fusione dell’acido ossalico
Il punto di fusione dell’acido etandioico è 189-191°C. Questa è la temperatura alla quale l’acido etandioico solido inizia a liquefarsi e diventare liquido. Il punto di fusione dell’acido etandioico può essere influenzato da vari fattori, come purezza, pressione e struttura cristallina. Il punto di fusione è un’importante proprietà fisica dell’acido etandioico perché aiuta a determinarne l’idoneità per varie applicazioni.
Densità dell’acido ossalico g/ml
La densità dell’acido etandioico è 1,90 g/ml. Ciò significa che un millilitro di acido etandioico pesa 1,90 grammi. La densità dell’acido etandioico può variare a seconda della temperatura, della pressione e della concentrazione della soluzione. La densità dell’acido etandioico è una proprietà importante utilizzata in molti processi chimici e industriali, come la determinazione della quantità di acido etandioico necessaria per una reazione o il calcolo del volume di una soluzione.
Peso molecolare dell’acido ossalico
Il peso molecolare dell’acido etandioico è 90,03 g/mol. È la somma dei pesi atomici di tutti gli atomi della molecola. Il peso molecolare dell’acido etandioico viene utilizzato in vari calcoli chimici, come la determinazione del numero di moli di acido etandioico in un dato campione o la concentrazione di una soluzione di acido etandioico.
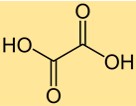
Struttura dell’acido ossalico
L’acido ossalico ha una struttura acida di-carbossilica, con due gruppi carbossilici (-COOH) attaccati a un atomo di carbonio centrale. La molecola ha una struttura planare, con i due gruppi carbossilici orientati perpendicolarmente. La struttura dell’acido ossalico lo rende un acido organico forte capace di donare due protoni in una soluzione.
| Aspetto | Polvere cristallina bianca |
| Peso specifico | 1,90 g/ml a 20°C |
| Colore | Incolore |
| Odore | Inodore |
| Massa molare | 90,03 g/mole |
| Densità | 1,90 g/ml a 20°C |
| Punto di fusione | 189-191°C |
| Punto di ebollizione | 365°C |
| Punto flash | Non applicabile |
| solubilità in acqua | 90 g/l a 20°C |
| Solubilità | Solubile in acqua, alcool, etere e glicerolo |
| Pressione del vapore | 0,0001 mmHg a 25°C |
| Densità del vapore | 3.3 (aria=1) |
| pKa | pKa1=1,25, pKa2=4,14 |
| pH | 1,2 (0,1 milioni di soluzioni) |
Sicurezza e pericoli dell’acido ossalico
L’acido ossalico è una sostanza pericolosa che può essere dannosa se non maneggiata correttamente. Può essere corrosivo per la pelle, gli occhi e il sistema respiratorio e causare irritazioni o ustioni al contatto. L’inalazione di polvere o vapori di acido etandioico può anche causare irritazione respiratoria e danni ai polmoni. Quando si maneggia l’acido etandioico, è importante indossare dispositivi di protezione individuale adeguati, come guanti, occhiali e un respiratore. Inoltre, deve essere conservato in un luogo fresco e asciutto, lontano da fonti di calore e ignizione. Lo smaltimento dell’acido etandioico deve essere effettuato in conformità con le normative locali.
| Simboli di pericolo | T,C |
| Descrizione della sicurezza | Evitare il contatto con la pelle e gli occhi. Indossare indumenti protettivi, guanti e protezioni per gli occhi/il viso adeguati. In caso di contatto con gli occhi, immediatamente con abbondante acqua e risciacquare un medico. In caso di incidente o di malessere consultare immediatamente il medico (se possibile, mostrargli l’etichetta). |
| Identificatori AN | UN3261 |
| Codice SA | 291711 |
| Classe di pericolo | 8 |
| Gruppo di imballaggio | III |
| Tossicità | LD50 orale: 750 mg/kg (ratto), LD50 cutanea: 1000 mg/kg (coniglio), LC50 inalatoria: 1100 ppm/8h (ratto) |
Metodi di sintesi dell’acido ossalico
Esistono diversi metodi per sintetizzare l’acido ossalico (acido etandioico), inclusa l’ossidazione dei carboidrati, l’ossidazione del glicole etilenico e la reazione del monossido di carbonio con l’idrossido di sodio .
Uno dei metodi più comuni è ossidare i carboidrati utilizzando l’acido nitrico. L’idrolisi dei carboidrati produce monosaccaridi, che poi ossideremo utilizzando acido nitrico e un catalizzatore come il pentossido di vanadio. Dopo aver trattato la miscela risultante con carbonato di calcio, la trattiamo con acido solforico per rilasciare acido etandioico.
Un altro metodo per sintetizzare l’acido etandioico è l’ossidazione del glicole etilenico utilizzando acido nitrico e un catalizzatore come platino o palladio. Ossidiamo il glicole etilenico in acido glicolico e quindi lo ossideremo ulteriormente in acido etandioico utilizzando acido nitrico e un catalizzatore. Trattiamo quindi la miscela risultante con carbonato di calcio e acido solforico per rilasciare acido etandioico.
Un terzo metodo per sintetizzare l’acido etandioico prevede la reazione del monossido di carbonio con l’idrossido di sodio in presenza di un catalizzatore come nichel o cobalto. La reazione del monossido di carbonio con l’idrossido di sodio produce formiato di sodio, che poi reagiamo con l’idrossido di sodio per produrre ossalato di sodio. Il trattamento dell’ossalato di sodio con acido solforico rilascia acido etandioico.
Usi dell’acido ossalico
L’acido ossalico ha molti usi diversi in vari settori grazie alle sue proprietà chimiche uniche. Ecco alcuni usi comuni dell’acido etandioico:
- Rimozione della ruggine: comunemente usato come rimozione della ruggine per superfici metalliche tra cui ferro, acciaio e rame.
- Candeggina: utilizzata nell’industria tessile per sbiancare tessuti e fibre.
- Lavorazione del legno: Utilizzato per rimuovere macchie dal legno, come macchie d’acqua o macchie causate da ferro o altri metalli.
- Agente detergente: utilizzato come detergente per varie superfici, inclusi sanitari di bagno e cucina, controsoffitti e pavimenti.
- Agente chelante: utilizzato anche come agente chelante in vari processi industriali, inclusa la produzione di ceramica e prodotti farmaceutici.
- Mordenzante: utilizzato come mordenzante nell’industria elettronica per rimuovere ossidi metallici e impurità dalle superfici dei semiconduttori.
- Fotografia: utilizzato in fotografia come agente di sviluppo per alcuni tipi di pellicole fotografiche.
- Usi medici: utilizzato in alcuni trattamenti medici, tra cui la rimozione dei depositi di calcio dal corpo e il trattamento delle infezioni del tratto urinario.
Domande:
D: Dove posso acquistare l’acido ossalico vicino a me?
R: L’acido ossalico può essere acquistato in molti negozi di ferramenta, negozi di bricolage e rivenditori online. Potrebbe anche essere disponibile presso negozi di forniture chimiche specializzate.
D: Come posso neutralizzare l’acido ossalico negli alimenti?
R: L’acido ossalico può essere neutralizzato negli alimenti aggiungendo una sostanza ricca di calcio, come latte o formaggio. Il calcio si legherà all’acido ossalico, riducendone l’effetto sul corpo.
D: Qual è la percentuale in massa di carbonio nell’acido ossalico, H2C2O4?
R: Il peso molecolare dell’acido ossalico è 90,03 g/mol. La massa di carbonio in una mole di acido etandioico è 24,02 g. Pertanto, la percentuale in massa di carbonio nell’acido etandioico è (24,02 g/90,03 g) x 100% = 26,66%.
D: Come posso ridurre l’acido ossalico negli spinaci?
R: L’acido ossalico può essere ridotto negli spinaci sbollentando gli spinaci prima di consumarli. Questo processo prevede la bollitura degli spinaci per un breve periodo e il successivo raffreddamento in acqua ghiacciata per ridurre il contenuto di acido etandioico.
D: Qual è la percentuale in massa di carbonio nell’acido ossalico, H2C2O4?
R: Il peso molecolare dell’acido ossalico è 90,03 g/mol. La massa di carbonio in una mole di acido etandioico è 24,02 g. Pertanto, la percentuale in massa di carbonio nell’acido etandioico è (24,02 g/90,03 g) x 100% = 26,66%.
D: H2C2O4 è un acido o una base?
R: H2C2O4 è un acido, noto anche come acido etandioico.
D: Qual è l’ordine di reazione di H2C2O4? R: L’ordine di reazione di H2C2O4 dipende dalla reazione specifica in questione. Può essere determinato sperimentalmente utilizzando metodi come il metodo del tasso iniziale o le leggi sui tassi integrati.
