L’acido nitrico (HNO3) è un acido inorganico forte e altamente reattivo. Viene utilizzato nei fertilizzanti, negli esplosivi e nell’industria della tintura e della stampa tessile. Forma anche nitrati, che svolgono un ruolo importante nei processi biologici e nelle reazioni di combustione.
| Nome IUPAC | Acido nitrico |
| Formula molecolare | HNO3 |
| numero CAS | 7697-37-2 |
| Sinonimi | Acqua forte, Spirito di nitro, Acido nitroso |
| InChI | InChI=1S/HNO3/c2-1(3)4 |
Proprietà dell’acido nitrico
Massa molare dell’acido nitrico
La massa molare dell’acido nitrico è 63,01 g/mol. È la quantità di sostanza che contiene lo stesso numero di entità (come atomi, molecole o ioni) di 12 grammi di carbonio-12 puro.
Formula dell’acido nitrico
La formula chimica dell’acido nitrico è HNO<sub>3</sub>. Rappresenta il numero e il tipo di atomi nella molecola. La formula può essere utilizzata per prevederne le proprietà fisiche e chimiche, come il punto di ebollizione, il punto di fusione e la densità.
Punto di ebollizione dell’acido nitrico
Il punto di ebollizione dell’acido nitrico è 83,0°C (181,4°F). È la temperatura alla quale una sostanza passa dallo stato liquido a quello gassoso ad una determinata pressione. L’acido nitrico è una sostanza altamente reattiva e volatile e il punto di ebollizione aiuta a determinare le condizioni in cui deve essere maneggiato e conservato.
Punto di fusione dell’acido nitrico
Il punto di fusione dell’acido nitrico è -41,5°C (-42,7°F). È la temperatura alla quale una sostanza solida cambia stato in liquido. Il basso punto di fusione dell’acido nitrico lo rende facile da maneggiare nella sua forma liquida.
Densità dell’acido nitrico g/ml
La densità dell’acido nitrico è 1,51 g/mL. È una misura della quantità di massa per unità di volume di una sostanza. La densità dell’acido nitrico può aiutare a determinarne i requisiti di stoccaggio e manipolazione, nonché il suo potenziale di reazione con altre sostanze.
Peso molecolare dell’acido nitrico
Il peso molecolare dell’acido nitrico è 63,01 g/mol. È la somma dei pesi atomici dei singoli atomi nella molecola. Il peso molecolare dell’acido nitrico è un fattore importante nel determinare le sue proprietà fisiche e chimiche.
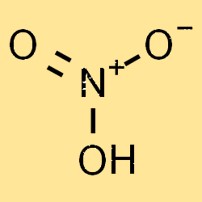
Struttura dell’acido nitrico
L’acido nitrico è un liquido incolore, altamente reattivo e volatile. La sua struttura molecolare è costituita da un atomo di azoto, un atomo di idrogeno e tre atomi di ossigeno, formando la formula chimica HNO3. Gli atomi di ossigeno sono disposti in una disposizione planare trigonale attorno all’atomo di azoto.
| Aspetto | Liquido incolore |
| Peso specifico | 1,51 g/ml |
| Colore | Incolore |
| Odore | Odore pungente, pungente |
| Massa molare | 63,01 g/mole |
| Densità | 1,51 g/ml |
| Punto di fusione | -41,5°C (-42,7°F) |
| Punto di ebollizione | 83,0°C (181,4°F) |
| Punto flash | Non applicabile |
| solubilità in acqua | Miscibile |
| Solubilità | Solubile in alcool, etere e altri solventi polari |
| Pressione del vapore | Allevato a temperatura ambiente |
| Densità del vapore | 1,48 (aria = 1) |
| pKa | -1.3 |
| pH | 1 (soluzione al 10%) |
Nota: il punto di infiammabilità dell’acido nitrico non è applicabile perché è un liquido. Il pH di una soluzione al 10% di acido nitrico è 1, il che indica che si tratta di un acido forte. Il pKa è il logaritmo negativo della costante di dissociazione acida, che è una misura della forza di un acido in soluzione.
Sicurezza e pericoli dell’acido nitrico
L’acido nitrico è una sostanza altamente reattiva e corrosiva che può causare lesioni gravi o mortali se non maneggiata correttamente. Ciò può causare ustioni, danni agli occhi e irritazione delle vie respiratorie. Quando si maneggia l’acido nitrico è necessario indossare dispositivi di protezione adeguati, come guanti e occhiali protettivi. Le aree di stoccaggio devono essere ben ventilate e le fuoriuscite devono essere pulite tempestivamente per prevenire il rilascio di fumi tossici. In caso di contatto con la pelle o gli occhi, sciacquare la zona interessata con acqua per almeno 20 minuti e consultare immediatamente un medico.
| Simboli di pericolo | Pericoloso per l’ambiente, Comburente, Nocivo, Irritante |
| Descrizione della sicurezza | S2 – Tenere fuori dalla portata dei bambini. S23 – Non respirare i fumi. S24/25 – Evitare il contatto con la pelle e gli occhi. S26 – In caso di contatto con gli occhi, lavare immediatamente e abbondantemente con acqua e consultare un medico. |
| Numeri di identificazione delle Nazioni Unite | ONU 2031 |
| Codice SA | 2811.90.90 |
| Classe di pericolo | 8 |
| Gruppo di imballaggio | III |
| Tossicità | Molto tossico per ingestione e inalazione. Può causare gravi ustioni e danni agli occhi, nonché irritazione respiratoria. |
Metodi di sintesi dell’acido nitrico
L’acido nitrico può essere sintetizzato con diversi metodi, tra cui:
- Processo di Ostwald: questo metodo prevede l’ossidazione dell’ammoniaca con l’aria per formare ossido nitrico, che viene poi ossidato ad acido nitrico.
- Nitrazione del toluene: questo metodo prevede la nitrazione del toluene per formare nitro-toluene, che viene poi ossidato per formare acido nitrico.
- Decomposizione termica del nitrato di ammonio: questo metodo prevede il riscaldamento del nitrato di ammonio per produrre ossido nitrico, che viene poi ossidato per formare acido nitrico.
- Ossidazione diretta dell’ammoniaca : questo metodo prevede l’ossidazione diretta dell’ammoniaca con l’ossigeno per produrre acido nitrico.
- Elettrolisi del nitrato di sodio: questo metodo prevede l’elettrolisi del nitrato di sodio per produrre acido nitrico.
Questi metodi variano in termini di efficacia, costi e impatto ambientale e la scelta del metodo dipende dall’uso finale desiderato e dalla scala di produzione.
Usi dell’acido nitrico
L’acido nitrico ha una vasta gamma di usi in vari settori, tra cui:
- Fertilizzante: l’acido nitrico viene utilizzato nella produzione di fertilizzanti azotati, come il nitrato di ammonio e i sali di acido nitrico.
- Prodotti farmaceutici: l’acido nitrico viene utilizzato come reagente nella produzione di prodotti farmaceutici e altri intermedi chimici.
- Esplosivi: l’acido nitrico viene utilizzato nella produzione di esplosivi, come dinamite e nitrocellulosa.
- Lavorazione dei metalli: l’acido nitrico viene utilizzato per il decapaggio, la pulizia e l’incisione dei metalli, inclusi acciaio, rame e alluminio.
- Tintura e stampa: utilizzato come mordente nei processi di tintura e stampa.
- Trattamento dell’acqua: l’acido nitrico viene utilizzato nel trattamento dell’acqua per controllare i livelli di pH e rimuovere le impurità.
- Ricerca e sviluppo: l’acido nitrico viene utilizzato come reagente di laboratorio per varie reazioni e analisi chimiche.
Nel complesso, l’acido nitrico ha una gamma versatile di applicazioni grazie alle sue proprietà acide e ossidanti, che lo rendono una sostanza chimica cruciale in vari processi industriali.
Domande:
L’acido nitrico è un acido forte o un acido debole?
Sì, l’acido nitrico (HNO3) è considerato un acido forte. Gli acidi forti si dissociano completamente in acqua per produrre ioni idrogeno (H+), il che significa che diventano completamente ionizzati. Al contrario, gli acidi deboli in acqua si ionizzano solo parzialmente, cioè non si dissociano completamente.
In una soluzione di acido nitrico, quasi ogni molecola avrà donato uno ione idrogeno, rendendola un potente donatore di protoni. Di conseguenza, l’acido nitrico ha un’alta concentrazione di ioni idrogeno e un pH basso, solitamente intorno a 1-2. La forza di un acido è determinata dalla sua capacità di donare ioni idrogeno e l’acido nitrico è uno degli acidi più forti nell’elenco degli acidi forti.
Si noti che l’acido nitrico (HNO3) ha un forte effetto ossidante e comporta il rischio di gravi ustioni e reazioni chimiche. Maneggiare l’acido nitrico con cura e indossare dispositivi di protezione adeguati.
