L’acido maleico è un composto organico con la formula C4H4O4. È un solido cristallino bianco utilizzato nella produzione di polimeri, adesivi e additivi alimentari.
| Nome IUPAC | Acido 2,3-diidrossibutandioico |
| Formula molecolare | C₄H₄O₄ |
| numero CAS | 110-16-7 |
| Sinonimi | Acido cis-butenedioico, acido cis-1,2-etilenedicarbossilico, acido tossico |
| InChI | InChI=1S/C4H4O4/c5-3(6)1-2-4(7)8/h1-2H,(H,5.6)(H,7.8) |
Proprietà dell’acido maleico
Formula dell’acido maleico
La formula dell’acido butenedioico è C4H4O4. È costituito da quattro atomi di carbonio, quattro atomi di idrogeno e quattro atomi di ossigeno. La formula rappresenta il numero esatto e i tipi di atomi presenti in una molecola di acido butenedioico.
Massa molare dell’acido maleico
La massa molare dell’acido butenedioico viene calcolata sommando le masse atomiche di tutti gli atomi nella sua formula. L’acido butenedioico ha una massa molare di circa 116,07 grammi per mole. Questo valore permette di determinare la quantità di acido butenedioico in una determinata quantità, utilizzando il concetto di moli.
Punto di ebollizione dell’acido maleico
L’acido butenedioico ha un punto di ebollizione compreso tra 160 e 162 gradi Celsius. Questa temperatura indica il punto in cui l’acido butenedioico passa dallo stato liquido a quello gassoso sotto pressione atmosferica standard.
Punto di fusione dell’acido maleico
Il punto di fusione dell’acido butenedioico è di circa 139-140 gradi Celsius. Ciò significa la temperatura alla quale l’acido butenedioico passa dalla forma solida a quella liquida. Questa caratteristica può essere utile in varie applicazioni e processi che coinvolgono l’acido butenedioico.
Densità dell’acido maleico g/ml
L’acido butenedioico ha una densità di circa 1,59 grammi per millilitro. La densità misura la massa di una sostanza per unità di volume. La densità dell’acido butenedioico determina il suo comportamento in diversi processi fisici e chimici, come la miscelazione con altre sostanze o la separazione da esse.
Peso molecolare dell’acido maleico
Il peso molecolare dell’acido butenedioico è 116,07 grammi per mole. È la somma dei pesi atomici di tutti gli atomi in una molecola di acido butenedioico. Il peso molecolare è essenziale in vari calcoli, come determinare la concentrazione o la quantità di acido butenedioico in una soluzione.
Struttura dell’acido maleico
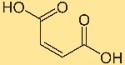
L’acido butenedioico ha una struttura costituita da due gruppi carbossilici (COOH) attaccati a una struttura carbonio-carbonio a doppio legame (C=C). Questa disposizione conferisce all’acido butenedioico le sue proprietà e reattività caratteristiche. La struttura gioca un ruolo cruciale nella comprensione del suo comportamento nelle reazioni chimiche e nelle interazioni con altri composti.
Solubilità dell’acido maleico
L’acido butenedioico è molto solubile in acqua, con una solubilità di circa 633 grammi per litro a 20 gradi Celsius. Questa elevata solubilità rende l’acido butenedioico facilmente solubile in soluzioni acquose e ne consente l’utilizzo in varie applicazioni, come nella produzione di polimeri e prodotti farmaceutici.
| Aspetto | Solido cristallino bianco |
| Peso specifico | 1,59 g/ml |
| Colore | Incolore |
| Odore | Inodore |
| Massa molare | 116,07 g/mole |
| Densità | 1,59 g/ml |
| Punto di fusione | 139-140°C |
| Punto di ebollizione | 160-162°C |
| Punto flash | Non applicabile |
| solubilità in acqua | Molto solubile |
| Solubilità | È altamente solubile in solventi polari come acqua e alcool. |
| Pressione del vapore | Non disponibile |
| Densità del vapore | Non disponibile |
| pKa | 1.92 |
| pH | ~1-2 |
Sicurezza e pericoli dell’acido maleico
L’acido butenedioico presenta alcune considerazioni e pericoli sulla sicurezza. Può causare irritazione alla pelle, agli occhi e al sistema respiratorio per contatto o inalazione. Si consiglia di indossare dispositivi di protezione, come guanti e occhiali, quando si maneggia l’acido butenedioico. In caso di ingestione accidentale, è necessario consultare immediatamente un medico. Anche l’acido butenedioico è combustibile e occorre prestare attenzione per evitare l’esposizione a fiamme libere o temperature elevate. Una buona ventilazione è fondamentale per prevenire l’accumulo di vapori. È importante conservare l’acido butenedioico in un’area sicura e ben ventilata, lontano da sostanze incompatibili. Seguire adeguate pratiche di sicurezza è essenziale quando si lavora con l’acido butenedioico.
| Simboli di pericolo | Corrosivo (C) |
| Descrizione della sicurezza | – Evitare il contatto con la pelle e gli occhi, – Utilizzare in un’area ben ventilata, – Indossare guanti e occhiali protettivi, – Conservare in un’area sicura e ben ventilata |
| Identificatori delle Nazioni Unite | UN3265 |
| Codice SA | 2917.11.00 |
| Classe di pericolo | 8 (Corrosivo) |
| Gruppo di imballaggio | III |
| Tossicità | Può causare irritazione alla pelle, agli occhi e al sistema respiratorio. Nocivo se ingerito. |
Metodi di sintesi degli acidi
Vari metodi consentono la sintesi dell’acido butenedioico. Un approccio popolare consiste nell’ossidare l’anidride maleica con un agente ossidante, come il permanganato di potassio o il perossido di idrogeno, in presenza di un catalizzatore. La reazione dà come prodotto l’acido butenedioico.
Un altro metodo consiste nell’idrolizzare l’anidride maleica facendola reagire con acqua, con conseguente formazione di acido butenedioico. A seconda delle condizioni desiderate e della velocità di reazione, questa reazione può avvenire in condizioni acide o alcaline.
L’ossidazione catalitica del butano o del benzene produce acido butenedioico ossidandoli con aria o ossigeno utilizzando un catalizzatore come il pentossido di vanadio. La miscela di reazione risultante viene sottoposta a ulteriori fasi di purificazione per isolare l’acido butenedioico.
Inoltre, i microrganismi possono fermentare carboidrati specifici per sintetizzare l’acido butenedioico. Questo metodo biologico prevede l’uso di batteri o funghi specifici che producono acido butenedioico come sottoprodotto metabolico.
Ciascuno di questi metodi di sintesi presenta vantaggi e considerazioni riguardanti le condizioni di reazione, la scalabilità e l’impatto ambientale. La scelta del metodo dipende da fattori quali la resa desiderata, i requisiti di purezza e la fattibilità complessiva del processo.
Usi dell’acido maleico
L’acido butenedioico trova varie applicazioni grazie alle sue proprietà versatili. Ecco alcuni dei suoi usi:
- Produzione di polimeri: la produzione di polimeri, come poliesteri e resine alchidiche, utilizza l’acido butenedioico come precursore, conferendo a questi materiali proprietà desiderabili come durata e flessibilità.
- Formulazione adesiva: le formulazioni adesive contengono acido butenedioico per migliorare le loro capacità di legame, promuovendo così l’adesione tra diversi substrati. Ciò lo rende utile in settori come quello edile e automobilistico.
- Industria alimentare e delle bevande: nell’industria alimentare e delle bevande, l’acido butenedioico funge da acidificante e esaltatore di sapidità, aggiungendo un sapore aspro a vari prodotti come caramelle, bibite e succhi di frutta.
- Industria tessile: l’industria tessile utilizza l’acido butenedioico nei processi di tintura e finissaggio, dove agisce come agente livellante del colorante, garantendo una distribuzione uniforme del colore sui tessuti.
- Applicazioni farmaceutiche: l’acido butenedioico trova applicazioni nell’industria farmaceutica per la sintesi di principi farmaceutici attivi (API) e come regolatore del pH nelle formulazioni farmaceutiche.
- Trattamento dell’acqua: l’acido butenedioico controlla le incrostazioni e la corrosione nei processi di trattamento dell’acqua, prevenendo la formazione di depositi minerali nei tubi e nelle apparecchiature.
- Cosmetici e prodotti per la cura personale: l’acido butenedioico regola il pH e agisce come agente chelante nei cosmetici e nei prodotti per la cura personale, stabilizzando le formulazioni e migliorandone l’efficacia.
- Applicazioni agricole: i derivati dell’acido butenedioico funzionano come regolatori della crescita delle piante ed erbicidi in agricoltura, aiutando a controllare la crescita delle erbe infestanti e a migliorare la resa dei raccolti.
La vasta gamma di applicazioni dell’acido butenedioico ne sottolinea l’importanza in vari settori, contribuendo allo sviluppo di numerosi prodotti e processi.
Domande:
D: Quanti atomi di H ionizzabili sono presenti in ciascuna molecola di acido maleico, C4H4O4?
R: Ci sono due atomi di H ionizzabili in ciascuna molecola di acido butenedioico.
D: L’acido maleico ha un momento dipolare?
R: Sì, l’acido butenedioico ha un momento dipolare dovuto alla presenza di legami polari all’interno della sua struttura.
D: Quali sono le formule molecolari del gliossile, dell’acido maleico e dell’acido acontico?
R: Le formule molecolari sono: gliossile (C2H2O2), acido butenedioico (C4H4O4), acido acontico (C6H6O6).
D: L’acido maleico o l’acido fumarico è più reattivo con il bromo?
R: L’acido butenedioico è più reattivo con il bromo rispetto all’acido fumarico.
D: Si verificherebbe l’isomerizzazione dell’acido maleico se la reazione fosse condotta in acqua neutra?
R: No, l’isomerizzazione dell’acido butenedioico non avverrebbe in acqua neutra.
D: Quanto erano vicini i tuoi valori pKa1 e pKa2 per l’acido maleico?
R: Il valore pKa1 dell’acido butenedioico è circa 1,92, mentre il valore pKa2 è circa 6,07.
D: Come dissolvere l’acido maleico?
R: L’acido butenedioico può essere sciolto in acqua mescolandolo a temperatura ambiente fino a quando non si dissolve completamente.
D: Quando è stato trovato l’acido maleico?
R: L’acido butenedioico fu scoperto nel 1834 dal chimico tedesco August Wilhelm von Hofmann.
D: Come reagisce l’etanolo con l’acido malico per formare acido maleico?
R: L’etanolo reagisce con l’acido malico in presenza di un agente disidratante, come l’acido solforico, per formare acido butenedioico.
D: L’acido maleico, se miscelato con HCl e riscaldato, forma acido fumarico?
R: Sì, l’acido butenedioico, quando miscelato con HCl e riscaldato, subisce una reazione di isomerizzazione per formare acido fumarico.
