L’acido idroiodico (HI) è un acido forte formato da idrogeno e iodio. Viene utilizzato nella sintesi organica e come agente riducente. È molto corrosivo e richiede un’attenta manipolazione.
| Nome IUPAC | Acido idroiodico |
| Formula molecolare | CIAO |
| numero CAS | 10034-85-2 |
| Sinonimi | Acido iodidrico, acido iodidrico, iodio |
| InChI | InChI=1S/HI/h1H |
Proprietà dell’acido iodidrico
Formula dell’acido idroiodico
La formula chimica dell’ioduro di idrogeno è HI. È costituito da un atomo di idrogeno (H) legato a un atomo di iodio (I). Questa semplice formula rappresenta la composizione di questo acido forte.
Massa molare dell’acido idroiodico
La massa molare dell’ioduro di idrogeno (HI) è di circa 127,91 grammi per mole (g/mol). Questo valore si calcola sommando le masse atomiche di un atomo di idrogeno e di un atomo di iodio.
Punto di ebollizione dell’acido idrico
L’ioduro di idrogeno ha un punto di ebollizione relativamente basso, intorno a -35 gradi Celsius (-31 gradi Fahrenheit). A questa temperatura, la forma liquida di HI passa allo stato gassoso.
Punto di fusione dell’acido idroiodico
Il punto di fusione dell’ioduro di idrogeno è di circa -51 gradi Celsius (-60 gradi Fahrenheit). A questa temperatura, la forma solida di HI si trasforma in uno stato liquido.
Densità dell’acido iodidrico g/mL
La densità dell’acido iodidrico è di circa 2,85 grammi per millilitro (g/mL). Questa misurazione della densità indica la massa di HI presente in un millilitro della sostanza.
Peso molecolare dell’acido idroiodico
L’ioduro di idrogeno ha un peso molecolare di circa 127,91 g/mol. Questo valore è la somma dei pesi atomici di idrogeno e iodio nella molecola HI.
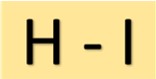
Struttura dell’acido iodidrico
L’acido idroiodico (HI) ha una struttura semplice. È costituito da un atomo di idrogeno legato ad un atomo di iodio da un singolo legame covalente. Questa disposizione molecolare conferisce all’HI le sue proprietà caratteristiche.
Solubilità dell’acido iodidrico
L’acido idroiodico ha un’elevata solubilità in acqua. Miscelato con acqua si dissolve facilmente formando una soluzione incolore. La sua elevata solubilità contribuisce al suo ampio utilizzo in varie applicazioni, inclusa la sintesi chimica.
| Aspetto | Liquido incolore |
| Peso specifico | 2,85 g/ml |
| Colore | Incolore |
| Odore | Acri |
| Massa molare | 127,91 g/mole |
| Densità | 2,85 g/ml |
| Punto di fusione | -51°C (-60°F) |
| Punto di ebollizione | -35°C (-31°F) |
| Punto flash | Non applicabile |
| solubilità in acqua | Miscibile, formando una soluzione incolore |
| Solubilità | Solubile in solventi organici |
| Pressione del vapore | Non disponibile |
| Densità del vapore | Non disponibile |
| pKa | -dieci |
| pH | Molto acido (pH < 1) |
Sicurezza e pericoli dell’acido idroiodico
Lo ioduro di idrogeno (HI) presenta notevoli rischi per la sicurezza a causa della sua natura corrosiva. Può causare gravi ustioni alla pelle e danni agli occhi in caso di contatto. L’inalazione dei suoi vapori provoca irritazione alle vie respiratorie. Durante la manipolazione dell’HI devono essere utilizzati dispositivi di protezione adeguati, come guanti e occhiali. Dovrebbe essere conservato in un’area ben ventilata, lontano da sostanze incompatibili. In caso di ingestione o inalazione accidentale, consultare immediatamente un medico. In caso di fuoriuscita, neutralizzare con agenti appropriati e smaltire come rifiuti pericolosi. È essenziale seguire rigorosi protocolli di sicurezza e maneggiare con cautela per evitare incidenti e lesioni.
| Simboli di pericolo | Corrosivo |
| Descrizione della sicurezza | Provoca gravi ustioni cutanee e lesioni oculari. Nocivo se inalato. |
| Numeri di identificazione delle Nazioni Unite | ONU1787 |
| Codice SA | 28111990 |
| Classe di pericolo | 8 (Sostanze corrosive) |
| Gruppo di imballaggio | II |
| Tossicità | Molto tossico |
Metodi per la sintesi dell’acido iodidrico
L’ioduro di idrogeno (HI) può essere sintetizzato con vari metodi. Un approccio comune prevede la reazione diretta dello iodio (I2) con il fosforo rosso (P). In questo metodo, I2 viene miscelato con fosforo rosso, che agisce come agente riducente. La reazione avviene in presenza di acqua, dando HI e acido fosforico.
Un altro metodo prevede la reazione dello iodio con l’idrazina idrata (N2H4·H2O). Questo processo richiede un’attenta gestione a causa della natura potenzialmente pericolosa dell’idrazina idrato. La reazione porta alla formazione di HI e azoto gassoso.
In alternativa, anche la reazione dello iodio con acido solforico concentrato (H2SO4) può produrre HI. In questo metodo, lo iodio viene miscelato con acido solforico concentrato, generando gas HI, che può essere raccolto e condensato in forma liquida.
È essenziale notare che la sintesi dell’ioduro di idrogeno deve essere effettuata con adeguate precauzioni di sicurezza. Le sostanze chimiche coinvolte possono essere pericolose e le reazioni possono generare gas tossici. Una ventilazione adeguata, dispositivi di protezione e il rispetto delle precauzioni di sicurezza sono cruciali durante il processo di sintesi per garantire una produzione sicura ed efficace di ioduro di idrogeno.
Usi dell’acido idroiodico
Lo ioduro di idrogeno (HI) trova varie applicazioni in vari settori grazie alle sue proprietà uniche. Ecco alcuni usi chiave:
- Sintesi organica: la chimica organica utilizza l’HI come reagente essenziale per convertire gli alogenuri alchilici in alcani, un processo noto come dealogenazione.
- Industria farmaceutica: la produzione di vari composti farmaceutici, compresi farmaci contenenti iodio e agenti di contrasto iodati per l’imaging medico, correlati all’HI.
- Agente riducente: HI funziona attivamente come un potente agente riducente nelle reazioni chimiche, aiutando nella riduzione degli ioni metallici alle loro forme elementari.
- Catalisi: HI partecipa attivamente come catalizzatore in alcune reazioni chimiche, aumentando la velocità di reazione e migliorando la resa di trasformazioni specifiche.
- Pulizia e incisione: le industrie elettroniche e dei semiconduttori utilizzano attivamente l’HI per i processi di pulizia e incisione grazie alla sua capacità di dissolvere metalli e ossidi metallici.
- Chimica analitica: le titolazioni iodometriche nella chimica analitica utilizzano attivamente l’HI per determinare la concentrazione di determinate sostanze in base alla loro reazione con lo iodio.
- Trattamento della superficie metallica: HI svolge attivamente un ruolo nella preparazione delle superfici metalliche per la placcatura, la brasatura e altri processi di trattamento superficiale.
- Produzione di ioduri: varie industrie utilizzano attivamente l’HI per produrre composti di ioduro per varie applicazioni in campi come la fotografia, la medicina e la sintesi organica.
- Reagente di laboratorio: i laboratori utilizzano attivamente l’HI come reagente utile per molte reazioni chimiche ed esperimenti.
Le proprietà versatili dell’ioduro di idrogeno lo rendono uno strumento prezioso nella ricerca chimica, nei processi industriali e nello sviluppo farmaceutico, contribuendo ai progressi in molteplici settori e alle scoperte scientifiche.
Domande:
D: Quale composto potrebbe essere aggiunto all’acido iodidico (HI) per neutralizzare le sue proprietà acide?
R: È possibile aggiungere una base, come l’idrossido di sodio (NaOH), per neutralizzare l’acido iodidrico e formare acqua e un sale.
D: L’acido idroiodico è un acido forte?
R: Sì, l’acido iodidrico è un acido forte, il che significa che si ionizza completamente in acqua, rilasciando ioni idrogeno.
D: Qual è la formula dell’acido idroiodico?
R: La formula dell’idrogeno ioduro è HI, che rappresenta un atomo di idrogeno legato a un atomo di iodio.
D: Quale delle seguenti è la formula dell’acido idroiodico?
R: La formula per l’ioduro di idrogeno è HI.
D: Quanti ml di acido idrico 0,550 M sono necessari per reagire con 10,00 ml di CsOH 0,217 M?
R: Sono necessari circa 17,58 ml di acido iodidrico 0,550 M per reagire con 10,00 ml di CsOH 0,217 M.
D: L’acido idroiodico è illegale?
R: L’ioduro di idrogeno in sé non è illegale, ma il suo utilizzo e il suo possesso possono essere regolamentati a causa dei suoi potenziali pericoli e delle applicazioni in attività illegali.
D: Cosa si formano l’ioduro di idrogeno e il solfuro di magnesio?
R: L’idrogeno ioduro e il solfuro di magnesio reagiscono per formare gas di idrogeno solforato (H2S) e sale di ioduro di magnesio (MgI2).
D: Cosa succede quando mescoli l’acido iodidrico con il bicarbonato di sodio?
R: Quando l’acido iodidrico reagisce con il bicarbonato di sodio (bicarbonato di sodio), produce anidride carbonica, acqua e ioduro di sodio.
D: Come funziona l’acido iodidrico nell’acqua?
R: L’idrogeno ioduro si ionizza in acqua, rilasciando ioni idrogeno (H+) e ioni ioduro (I-), risultando in una soluzione molto acida.
D: Equazione ionica netta di idrossido di sodio e acido iodidrico?
R: L’equazione ionica netta per la reazione tra idrossido di sodio (NaOH) e acido iodidrico (HI) è Na+ + OH- + H+ + I- → Na+ + I- + H2O.
