L’acido idrazoico (HN3) è un composto altamente volatile. È incolore e ha un odore pungente. Viene utilizzato nelle reazioni chimiche e può essere tossico ed esplosivo.
| Nome IUPAC | Acido idrazoico |
| Formula molecolare | HN3 |
| numero CAS | 7782-79-8 |
| Sinonimi | Azoimide, idrogeno azide, acido azotico, acido idronitrico, acido triazoico |
| InChI | InChI=1S/HN3/c1-3-2/h1H |
Proprietà dell’acido idrazoico
Formula dell’acido idrazoico
La formula chimica dell’acido idrazoico è HN3. È costituito da un atomo di idrogeno e tre atomi di azoto legati insieme in modo covalente. Questa semplice formula rappresenta la composizione di base del composto, fondamentale per comprenderne le proprietà e le reazioni.
Massa molare dell’acido idrazoico
La massa molare dell’idrogeno azide (HN3) è di circa 43,03 grammi per mole. Questo valore si ottiene sommando le masse atomiche di un atomo di idrogeno (H) e tre atomi di azoto (N). La massa molare è essenziale per il calcolo della stechiometria nelle reazioni chimiche.
Punto di ebollizione dell’acido idrazoico
L’idrogeno azide ha un punto di ebollizione relativamente basso, intorno a 37 gradi Celsius (98,6 gradi Fahrenheit). A causa della sua natura volatile, vaporizza facilmente in forma gassosa a temperature moderate. È necessaria la massima cautela quando si maneggia questo composto.
Punto di fusione dell’acido idrazoico
Il punto di fusione dell’idrogeno azide è di circa -80 gradi Celsius (-112 gradi Fahrenheit). A questa temperatura il composto solido passa alla forma liquida. Essendo molto reattivo, il suo stato solido richiede un’adeguata conservazione e manipolazione.
Densità dell’acido idrazoico g/mL
La densità dell’idrogeno azide è di circa 1,09 grammi per millilitro. Questo valore indica la sua massa per unità di volume, riflettendo la sua compattezza e concentrazione in un dato spazio. È un parametro critico per le misurazioni di laboratorio.
Peso molecolare dell’acido idrazoico
Il peso molecolare dell’idrogeno azide (HN3) è 43,03 grammi per mole. È la somma dei pesi atomici degli elementi presenti in una singola molecola del composto. Il peso molecolare gioca un ruolo vitale nel determinare il suo comportamento fisico e chimico.
Struttura dell’acido idrazoico
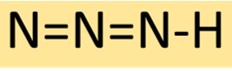
L’idrogeno azide ha una struttura molecolare lineare, costituita da tre atomi di azoto legati in sequenza con un singolo atomo di idrogeno all’estremità. Questa disposizione si traduce in un composto stabile ma altamente reattivo, spesso utilizzato nella sintesi chimica.
Solubilità dell’acido idrazoico
L’idrogeno azide ha una solubilità limitata in acqua, rendendolo un composto scarsamente solubile. Può dissolversi in piccola misura in soluzioni acquose, ma la sua bassa solubilità ne limita l’uso in alcune applicazioni. È necessaria particolare attenzione quando si tratta la sua forma acquosa a causa della sua natura tossica ed esplosiva.
| Aspetto | Liquido incolore |
| Peso specifico | 1,09 g/ml |
| Colore | Incolore |
| Odore | Odore pungente |
| Massa molare | 43,03 g/mole |
| Densità | 1,09 g/ml |
| Punto di fusione | -80°C (-112°F) |
| Punto di ebollizione | 37°C (98,6°F) |
| Punto flash | Non applicabile |
| solubilità in acqua | Leggermente solubile |
| Solubilità | Solubile in solventi alcalini e organici come alcool, etere |
| Pressione del vapore | 23,1 mmHg a 20°C |
| Densità del vapore | 1,4 (aria = 1) |
| pKa | 4.6 |
| pH | Circa 3-4 |
Sicurezza e pericoli dell’acido idrazoico
L’idrogeno azide comporta notevoli rischi per la sicurezza. È altamente tossico e può causare gravi effetti sulla salute se esposto. L’inalazione dei suoi vapori o nebbie può causare irritazione respiratoria, vertigini e persino la morte. Il contatto con la pelle o gli occhi può causare ustioni, irritazioni e danni ai tessuti. Il composto è inoltre estremamente infiammabile e può formare miscele esplosive. Reagisce violentemente con diverse sostanze, come metalli e agenti ossidanti. È necessario seguire misure di sicurezza adeguate quando si maneggia l’idrogeno azide, compreso indossare indumenti protettivi, utilizzare un’adeguata ventilazione e conservarlo in modo sicuro per evitare incidenti o rilasci nell’ambiente. l’ambiente.
| Simboli di pericolo | Teschio e Ossa Incrociate, Corrosivo |
| Descrizione della sicurezza | Molto tossico, corrosivo |
| Numeri di identificazione delle Nazioni Unite | UN1687 |
| Codice SA | 2811.29.10 |
| Classe di pericolo | 6.1 (Sostanze tossiche) |
| Gruppo di imballaggio | II (Pericolo medio) |
| Tossicità | Molto tossico; può essere fatale in piccole quantità |
Metodi per la sintesi dell’acido idrazoico
Vari metodi consentono la sintesi dell’idrogeno azide.
Un approccio comune prevede la reazione tra sodio azide (NaN3) e un acido, come l’acido solforico (H2SO4) o l’acido cloridrico (HCl) . In questo metodo, l’acido si mescola con la sodio azide, dando luogo alla formazione di idrogeno azide e del corrispondente sale dell’acido utilizzato.
Un altro metodo prevede la reazione tra sodio azide e un alogenuro alchilico, come ioduro di metile (CH3I) o ioduro di etile (C2H5I). Questa reazione, nota come riarrangiamento di Curtius, porta alla formazione di idrogeno azide come prodotto.
La reazione tra sodio azide e acido nitroso (HNO2) produce idrogeno azide. Per generare acido nitroso in situ, il nitrito di sodio (NaNO2) viene generalmente aggiunto a una soluzione acida. La reazione tra sodio azide e acido nitroso produce idrogeno azide.
È importante notare che la sintesi dell’idrogeno azide richiede un’attenta manipolazione e adeguate misure di sicurezza. A causa della sua tossicità e della natura esplosiva, le reazioni devono essere condotte in un’area ben ventilata, utilizzando dispositivi di protezione adeguati e seguendo i protocolli stabiliti.
Ciascun metodo di sintesi presenta vantaggi e limiti e la scelta del metodo dipende da fattori quali la disponibilità dei reagenti, la resa desiderata e considerazioni sulla sicurezza. Una buona conoscenza ed esperienza nella gestione di sostanze chimiche pericolose sono essenziali per condurre queste sintesi in modo efficiente e sicuro.
Usi dell’acido idrazoico
L’idrogeno azide trova applicazioni in vari campi grazie alle sue proprietà uniche. Ecco alcuni dei suoi usi:
- Reagente chimico: l’idrogeno azide funge da reagente chimico versatile nella sintesi organica, partecipando attivamente a molte reazioni, inclusa la sintesi di azidi, che sono elementi fondamentali nei prodotti farmaceutici e nei coloranti.
- Detonatori e propellenti: i produttori utilizzano l’idrogeno azide per la produzione di detonatori e propellenti utilizzati negli airbag e nei dispositivi di sicurezza, beneficiando della sua natura esplosiva e della rapida decomposizione, che rilascia attivamente gas azoto, che lo rende prezioso in queste applicazioni.
- Analisi di laboratorio: la chimica analitica utilizza l’idrogeno azide per il rilevamento e la determinazione attivi di vari elementi e composti. Forma attivamente complessi con metalli specifici, consentendone la quantificazione mediante metodi colorimetrici o di titolazione.
- Ricerca biochimica: nella ricerca biochimica, gli scienziati utilizzano attivamente l’idrogeno azide per modificare le biomolecole e studiarne le funzioni. Reagisce selettivamente con alcuni gruppi funzionali, contribuendo così attivamente all’identificazione e alla caratterizzazione delle molecole biologiche.
- Fotografia: nella tradizionale fotografia in bianco e nero, l’idrogeno azide funziona attivamente come sensibilizzatore nelle emulsioni, migliorando la sensibilità alla luce delle pellicole fotografiche e portando attivamente a una migliore qualità dell’immagine.
- Inibitore della corrosione: le industrie utilizzano attivamente l’idrogeno azide come inibitore della corrosione per i metalli, in particolare il rame e le sue leghe. Forma attivamente uno strato protettivo sulla superficie metallica, prevenendo attivamente la corrosione e prolungando la durata di varie apparecchiature e strutture.
- Generatori di gas: l’idrogeno azide svolge un ruolo attivo nei generatori di gas per airbag e sistemi di salvataggio. La sua rapida decomposizione rilascia attivamente gas azoto, fornendo la forza necessaria per il gonfiaggio e il dispiegamento.
Domande:
D: L’acido idrazoico è caustico?
R: Sì, l’acido idrazoico è considerato caustico e può causare ustioni e danni ai tessuti al contatto.
D: L’acido idrazoico è un acido forte?
R: Sì, l’acido idrazoico è classificato come un acido forte, in grado di ionizzarsi completamente in acqua per rilasciare ioni idronio.
D: L’acido idrazoico è un acido ternario?
R: No, l’acido idrazoico non è un acido ternario. Gli acidi ternari contengono tre diversi elementi (idrogeno, ossigeno e un terzo elemento), mentre l’acido idrazoico contiene solo idrogeno, azoto e ossigeno.
D: Quanti ml di acido idrazoico per 12,5 ml?
R: La domanda sembra incompleta e richiede informazioni aggiuntive per una risposta accurata.
D: Qual è la struttura di Lewis corretta per l’acido idrazoico (HN3), comprese le eventuali cariche formali?
R: La struttura di Lewis corretta per HN3 consiste in un atomo di azoto centrale legato ad altri tre atomi di azoto e un atomo di idrogeno. Le cariche formali possono essere determinate in base alle differenze di elettronegatività.
D: In che modo l’acido idrazoico influisce sulla citocromo c ossidasi?
R: L’idrogeno azide inibisce la citocromo c ossidasi, un enzima coinvolto nella respirazione cellulare, legandosi al suo sito attivo e interrompendone la funzione.
D: Qual è la Ka dell’acido idrazoico se l’acido idrazoico 0,20 M ha un pH di 3,21?
R: La Ka dell’acido idrazoico può essere calcolata utilizzando il pH e l’equazione Ka = [H3O+][A-]/[HA]. Sono necessarie ulteriori informazioni per determinare il valore Ka.
D: Qual è lo stato di ossidazione dell’azoto nell’acido idrazoico (HN3)?
R: Lo stato di ossidazione dell’azoto nell’acido idrazoico è -1.
D: Qual è il pH di una soluzione 0,15 molare di HN3 se Ka = 1,8 × 10^-9?
R: Il pH di una soluzione 0,15 molare di HN3 può essere calcolato utilizzando il valore Ka e l’equazione pH = -log10(sqrt(Ka × [HA])).
D: Come bilanciare N2 + H2 in HN3?
R: L’equazione bilanciata per la reazione N2 + H2 → HN3 sarebbe 3N2 + 6H2 → 2HN3.
D: Come calcolare la Ka di HN3?
R: La Ka di HN3 può essere calcolata utilizzando la concentrazione di equilibrio dei prodotti e dei reagenti nella reazione di dissociazione dell’HN3.
D: Qual è la molarità di NaN3 se la molarità di HN3 è 0,012 M?
R: La molarità di NaN3 non può essere determinata senza informazioni aggiuntive o senza l’equazione bilanciata per la reazione tra NaN3 e HN3.
D: Qual è la struttura di Lewis corretta per l’acido idrazoico (HN3), comprese le eventuali cariche formali?
R: La struttura di Lewis corretta per HN3 include un atomo di azoto centrale legato ad altri tre atomi di azoto e un atomo di idrogeno. Le cariche formali possono essere determinate in base alle differenze di elettronegatività.
