L’acido fosforico (H3PO4) è un acido minerale incolore e inodore. È ampiamente utilizzato nell’industria alimentare e delle bevande come agente aromatizzante e come inibitore della ruggine nell’industria automobilistica.
| Nome IUPAC | Acido fosforico |
| Formula molecolare | H3PO4 |
| numero CAS | 7664-38-2 |
| Sinonimi | Acido ortofosforico, triidrossidoossidofosforo, acido fosforico (V), acido ortofosforico, tecnologia dell’acido fosforico trasparente, fosforsaeur |
| InChI | InChI=1S/H3O4P/c1-5(2,3)4/h(H3,1,2,3,4) |
Proprietà dell’acido fosforico
Massa molare dell’acido fosforico
La massa molare dell’acido fosforico è 98,00 g/mol. Questo valore viene calcolato sommando le masse atomiche di ciascuno degli atomi costituenti la molecola, che sono un atomo di fosforo e tre atomi di ossigeno. La massa molare è una proprietà importante di un composto perché viene utilizzata per calcolare la quantità di sostanza presente in un dato campione utilizzando il numero di Avogadro. Inoltre, la massa molare dell’acido fosforico viene utilizzata per determinare la concentrazione di una soluzione mediante titolazione.
Formula dell’acido fosforico
La formula chimica dell’acido fosforico è H3PO4, che indica che contiene un atomo di fosforo, tre atomi di idrogeno e quattro atomi di ossigeno. È un acido debole che può donare fino a tre ioni idrogeno a una base. La formula è importante perché ci permette di scrivere equazioni chimiche e calcolare la stechiometria delle reazioni chimiche che coinvolgono l’acido fosforico. Inoltre, la formula viene utilizzata per calcolare la concentrazione di una soluzione di acido fosforico mediante titolazione.
Punto di ebollizione dell’acido fosforico
Il punto di ebollizione dell’acido fosforico è 158°C (316°F) alla pressione di 1 atmosfera. Ciò significa che a questa temperatura e pressione la fase liquida dell’acido fosforico si trasformerà in una fase gassosa. Il punto di ebollizione dipende dalle forze intermolecolari presenti nel composto e, nel caso dell’acido fosforico, è dovuto alla presenza di legami idrogeno tra le molecole. Il punto di ebollizione è una proprietà fisica importante di un composto perché viene utilizzato per determinarne la volatilità, utile in molti processi industriali.
Punto di fusione dell’acido fosforico
Il punto di fusione dell’acido fosforico è 42,35°C (108,23°F). Questa è la temperatura alla quale la fase solida dell’acido fosforico si trasformerà nella fase liquida. Il punto di fusione dipende dall’intensità delle forze intermolecolari presenti nel composto e, nel caso dell’acido fosforico, è dovuto alla presenza di legami idrogeno tra le molecole. Il punto di fusione è una proprietà fisica importante di un composto perché viene utilizzato per determinarne la purezza e stabilirne l’identità.
Densità dell’acido fosforico g/ml
La densità dell’acido fosforico è 1,685 g/ml a temperatura ambiente (25°C o 77°F). Questa è la massa della sostanza per unità di volume. La densità è una proprietà fisica di una sostanza e viene utilizzata per calcolare il volume di una determinata massa della sostanza o la massa di un dato volume della sostanza. La densità dell’acido fosforico è importante in molti processi industriali, inclusa la produzione di fertilizzanti, detergenti e additivi alimentari.
Peso molecolare dell’acido fosforico
Il peso molecolare dell’acido fosforico è 98,00 g/mol. È la somma dei pesi atomici di tutti gli atomi della molecola. Il peso molecolare è una proprietà importante di un composto perché viene utilizzato per calcolare la quantità di sostanza presente in un dato campione. Inoltre, il peso molecolare dell’acido fosforico viene utilizzato per determinare la concentrazione di una soluzione mediante titolazione.
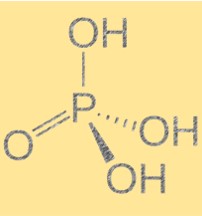
Struttura dell’acido fosforico (H3PO4)
L’acido fosforico ha una formula molecolare di H3PO4 e una geometria molecolare tetraedrica. È un acido triprotico, il che significa che può donare tre ioni idrogeno a una base. La molecola contiene un atomo di fosforo legato a quattro atomi di ossigeno, tre dei quali sono legati ad atomi di idrogeno. La struttura dell’acido fosforico è importante perché ne determina le proprietà chimiche e fisiche. La presenza di legami idrogeno tra le molecole dà origine a punti di ebollizione e fusione elevati.
| Aspetto | Liquido incolore |
| Peso specifico | 1.685 a 25°C |
| Colore | Incolore |
| Odore | Inodore |
| Massa molare | 98,00 g/mole |
| Densità | 1.685 g/ml a 25°C |
| Punto di fusione | 42,35°C (108,23°F) |
| Punto di ebollizione | 158°C (316°F) alla pressione di 1 atm |
| Punto flash | Non applicabile |
| solubilità in acqua | Completamente solubile in acqua |
| Solubilità | Solubile in etanolo, etere etilico e acetone |
| Pressione del vapore | 0,0002 mmHg a 20°C |
| Densità del vapore | 3,5 (aria = 1) |
| pKa | pKa1=2.148, pKa2=7.198, pKa3=12.319 |
| pH | 1,0 – 2,5 (soluzione concentrata), 2,8 – 3,2 (soluzione diluita) |
H3PO4 Sicurezza e pericoli
L’acido fosforico presenta diversi rischi per la sicurezza e deve essere maneggiato con cura. Può causare gravi irritazioni alla pelle e agli occhi ed è molto corrosivo per i metalli. Il contatto diretto con la pelle, gli occhi o le mucose può causare gravi ustioni o addirittura danni permanenti. L’inalazione dei fumi può provocare irritazioni alle vie respiratorie e ustioni. Non deve essere ingerito poiché può causare gravi ustioni interne e disturbi gastrointestinali. Quando si maneggia l’acido fosforico, è necessario indossare dispositivi di protezione individuale adeguati come guanti, occhiali e un respiratore. Dovrebbe inoltre essere conservato in un luogo fresco e asciutto, lontano da materiali incompatibili come agenti ossidanti e alcali.
| Simboli di pericolo | Corrosivo |
| Descrizione della sicurezza | Tieni il contenitore chiuso ermeticamente. Indossare guanti/indumenti protettivi/proteggere gli occhi/il viso. |
| Numeri di identificazione delle Nazioni Unite | ONU1805 |
| Codice SA | 280920 |
| Classe di pericolo | 8 (Sostanze corrosive) |
| Gruppo di imballaggio | II (pericolo medio) |
| Tossicità | LD50 orale (ratto) – 1533 mg/kg |
Metodi di sintesi di H3PO4
Esistono diversi metodi per sintetizzare l’acido fosforico (H3PO4).
Il metodo più comune è il processo a umido che prevede la reazione del fosfato naturale con acido solforico . Per produrre solfato di calcio (gesso) e H3PO4, la roccia fosfatica viene prima frantumata e poi miscelata con acido solforico concentrato. Dopo aver filtrato la sospensione risultante, la serie di fasi di estrazione con solvente e precipitazione purifica l’H3PO4.
Un altro metodo per sintetizzare H3PO4 è il processo termico che prevede il riscaldamento della roccia fosfatica ad alta temperatura per produrre H3PO4 e altri sottoprodotti come fosforo elementare e ossido di calcio. Questo metodo è meno comune del processo a umido a causa del suo elevato fabbisogno energetico.
La reazione del pentossido di fosforo con l’acqua sintetizza H3PO4. Le industrie elettroniche e dei semiconduttori utilizzano comunemente questo metodo per produrre H3PO4 ad elevata purezza.
Altri metodi per sintetizzare H3PO4 includono l’ossidazione elettrochimica del fosforo, l’idrolisi del tricloruro di fosforo e la reazione del fosforo con acido nitrico . Questi metodi sono meno comuni dei processi umidi e termici a causa del loro costo elevato e della loro complessità.
Usi di H3PO4
L’acido fosforico è un composto versatile che ha una vasta gamma di applicazioni in vari settori. Alcuni dei suoi usi principali sono:
- Produzione di fertilizzanti: componente principale della produzione di fertilizzanti come fosfato biammonico e triplo perfosfato.
- Industria alimentare e delle bevande: utilizzato come additivo alimentare e agente aromatizzante in vari prodotti alimentari e bevande come bevande a base di cola, marmellate e formaggi fusi.
- Pulizia industriale: utilizzato come detergente e antiruggine nel settore industriale grazie alla sua capacità di sciogliere la ruggine e altri depositi minerali.
- Trattamento dell’acqua: utilizzato per controllare i livelli di pH dell’acqua nei processi industriali e anche per rimuovere metalli pesanti e altre impurità.
- Prodotti farmaceutici: utilizzato nella produzione di prodotti farmaceutici e integratori alimentari grazie alla sua capacità di regolare i livelli di pH.
- Odontoiatria: utilizzato in procedure dentistiche come il trattamento canalare e come componente del cemento dentale.
- Trattamento dei metalli: utilizzato per trattare e passivare metalli come acciaio inossidabile, alluminio e titanio per migliorarne la resistenza alla corrosione.
- Elettronica: utilizzato nell’industria elettronica come detergente e come componente nella produzione di semiconduttori.
Domande:
D: Qual è la formula dell’acido fosforico?
R: La formula dell’acido fosforico è H3PO4.
D: H3PO4 è un acido forte?
R: No, H3PO4 non è considerato un acido forte. È un acido debole con un valore pKa di 2,15.
D: H3PO4 è un acido o una base?
R: H3PO4 è un acido perché dona un protone (H+) quando disciolto in acqua.
D: Qual è la struttura di Lewis per H3PO4?
R: La struttura di Lewis per H3PO4 è una struttura tetraedrica con un atomo di fosforo centrale circondato da quattro atomi di ossigeno. Ciascun atomo di ossigeno forma un singolo legame con l’atomo di fosforo e su ciascun atomo di ossigeno sono presenti anche tre coppie di elettroni solitari.
D: L’acido fosforico è un acido forte? R: No, l’acido fosforico non è considerato un acido forte. È un acido debole con un valore pKa di 2,15 per la prima donazione di protoni e 7,20 per la seconda donazione di protoni.
