L’acido fluoroantimonico è uno dei più potenti superacidi conosciuti, con una funzione di acidità Hammett pari a -21. È una miscela di acido fluoridrico e pentafluoruro di antimonio.
| Nome IUPAC | Acido fluoroantimoniico (V) |
| Formula molecolare | H[SbF6] |
| numero CAS | 16950-06-4 |
| Sinonimi | Esafluoroantimoniato di idrogeno (V), esafluoruro di antimonio idrato, acido fluoridrico di antimonio, acido fluoridrico con pentafluoroantimonio (1:1) |
| InChI | InChI=1S/F6Sb.H/h1H;/q+1;/p-1 |
pH dell’acido fluoroantimonico
L’acido fluoroantimonico è un superacido e ha un pH inferiore a -14. Questo perché la scala del pH misura la concentrazione di ioni idrogeno (H+) in una soluzione e i superacidi hanno concentrazioni di ioni H+ più elevate rispetto all’acqua pura.
I misuratori di pH tradizionali non possono misurare con precisione il pH dell’acido fluoroantimonico perché non sono progettati per gestire acidi così forti. Invece, gli scienziati utilizzano la funzione di acidità di Hammett per misurare l’acidità dell’acido fluoroantimonico. La funzione di acidità di Hammett confronta l’acidità dei superacidi utilizzando il grado di protonazione di un composto di riferimento. L’acido fluoroantimonico ha una funzione di acidità Hammett pari a -21, che è il valore più negativo possibile e indica che è uno dei più potenti superacidi conosciuti.
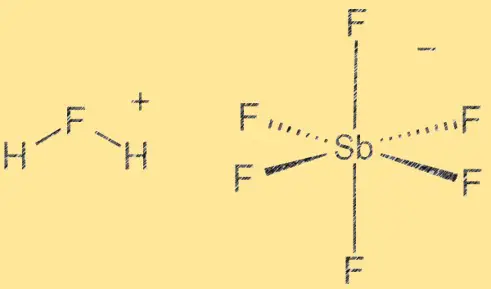
Struttura dell’acido fluoroantimonico:
L’acido fluoroantimonico ha una struttura molecolare costituita da uno ione idrogeno (H+) e uno ione esafluoroantimonato (V) ([SbF6]^-). Lo ione SbF6 agisce come un acido di Lewis, mentre lo ione H+ agisce come un acido di Bronsted. Il composto è altamente polare a causa della differenza di elettronegatività tra gli atomi di idrogeno e di fluoro. Il legame tra antimonio e fluoruro è covalente, mentre il legame tra idrogeno e fluoruro è covalente polare.
Massa molare dell’acido fluoroantimonico:
L’acido fluoroantimonico ha una massa molare di 216,74 g/mol. È un superacido altamente reattivo e corrosivo composto da acido fluoridrico (HF) e pentafluoruro di antimonio (SbF5). L’elevata massa molare dell’acido fluoroantimonico può essere attribuita alla presenza dell’atomo pesante di antimonio nella sua struttura molecolare.
Punto di ebollizione dell’acido fluoroantimonico:
HSbF6 è un composto altamente reattivo e instabile e pertanto non ha un punto di ebollizione definito. Si decompone a temperature superiori a -10°C, liberando fumi tossici di gas di acido fluoridrico. Il suo punto di ebollizione è stimato intorno ai 20-30°C, ma questo non è un parametro utile per descrivere le proprietà di HSbF6.
Punto di fusione dell’acido fluoroantimonico:
HSbF6 non ha un punto di fusione ben definito a causa della sua natura altamente reattiva. Può esistere solo allo stato liquido e si decompone rapidamente quando si raffredda a temperature più basse. Si stima che si decompone intorno a -90°C, liberando fumi tossici di acido fluoridrico e pentafluoruro di antimonio.
Densità dell’acido fluoroantimonico g/ml:
La densità di HSbF6 è 2,1 g/mL. Questa elevata densità può essere attribuita alla presenza di atomi di antimonio pesanti nella sua struttura molecolare. È un composto altamente corrosivo e reattivo e deve essere maneggiato con estrema cautela. Anche la densità di HSbF6 lo rende difficile da maneggiare in laboratorio.
Peso molecolare dell’acido fluoroantimonico:
Il peso molecolare dell’acido fluoroantimonico è 236,76 g/mol. È composto da uno ione idrogeno, uno ione antimonio e sei ioni fluoruro. L’elevato peso molecolare dell’acido fluoroantimonico può essere attribuito alla presenza dell’atomo pesante di antimonio nella sua struttura molecolare.
Formula dell’acido fluoroantimonico:
La formula chimica dell’acido fluoroantimonico è H[SbF6]. È composto da uno ione idrogeno (H+) e uno ione esafluoroantimonato (V) ([SbF6]^-). Lo ione [SbF6]^- è formato dalla reazione del pentafluoruro di antimonio (SbF5) con acido fluoridrico (HF). La formula rappresenta il rapporto intero più semplice degli atomi presenti nel composto.
| Aspetto | Liquido da incolore a giallo pallido |
| Peso specifico | 2,1 g/ml |
| Colore | Da incolore a giallo pallido |
| Odore | Inodore |
| Massa molare | 236,76 g/mole |
| Densità | 2,1 g/ml |
| Punto di fusione | Si decompone intorno a -90°C |
| Punto di ebollizione | Si decompone sopra i -10°C |
| Punto flash | Non applicabile |
| solubilità in acqua | Reagisce violentemente con l’acqua |
| Solubilità | Solubile in HF anidro, SbF5, SO2F2 e SO2ClF |
| Pressione del vapore | Non applicabile |
| Densità del vapore | Non applicabile |
| PKa | -21 (funzione dell’acidità di Hammett) |
| pH | Meno di -14 |
Nota: l’acido fluoroantimonico è un composto altamente reattivo e corrosivo che deve essere maneggiato con estrema cautela. Le sue proprietà fisiche e chimiche sono difficili da misurare con precisione a causa della sua natura instabile e dei metodi limitati disponibili per la sua manipolazione. I valori elencati in questa tabella sono stime basate sulla letteratura disponibile e potrebbero non essere precise.
Sicurezza e pericoli dell’acido fluoroantimonico
L’acido fluoroantimonico è una sostanza estremamente pericolosa e altamente corrosiva che comporta rischi significativi per la salute e la sicurezza. È un potente agente ossidante che può reagire violentemente con l’acqua, i composti organici e persino alcuni metalli. Può causare gravi ustioni e danni ai tessuti a contatto con la pelle o gli occhi e l’inalazione dei suoi vapori può causare difficoltà respiratorie e danni ai polmoni.
Il personale addestrato deve maneggiare l’acido fluoroantimonico utilizzando attrezzature specializzate e indumenti protettivi in laboratori ben ventilati e adeguatamente attrezzati. Le agenzie di regolamentazione regolamentano e limitano rigorosamente l’uso dell’acido fluoroantimonico a causa del suo potenziale di causare lesioni gravi e danni ambientali.
| Simboli di pericolo | Corrosivo |
| Descrizione della sicurezza | Non respirare i vapori. Indossare guanti, indumenti e protezioni per gli occhi/il viso. Evitare il contatto con la pelle, gli occhi e gli indumenti. Utilizzare solo sotto una cappa chimica. |
| Numeri di identificazione delle Nazioni Unite | UN3264 |
| Codice SA | 28111990 |
| Classe di pericolo | 8 (Sostanze corrosive) |
| Gruppo di imballaggio | III |
| Tossicità | Molto tossico e corrosivo; può causare gravi ustioni e danni ai tessuti a contatto con la pelle o gli occhi e l’inalazione dei suoi vapori può causare difficoltà respiratorie e danni ai polmoni. |
Metodi per la sintesi dell’acido fluoroantimonico
L’acido fluoroantimonico (HSbF6) viene solitamente sintetizzato miscelando fluoruro di idrogeno (HF) e pentafluoruro di antimonio (SbF5) in un rapporto molare di 1:1. La reazione avviene in condizioni anidre e a basse temperature per impedire la decomposizione del superacido risultante. La reazione complessiva può essere rappresentata come segue:
HF + SbF5 → HSbF6
La reazione è altamente esotermica e può rilasciare una grande quantità di calore. Pertanto, viene solitamente effettuato in un ambiente ben ventilato e controllato, come una cappa chimica, utilizzando adeguate misure protettive.
Per preparare HSbF6, il trifluoruro di antimonio (SbF3) può essere fatto reagire con HF in presenza di un agente ossidante come SbF5 o difluoruro di anidride solforosa (SO2F2). Questa reazione richiede condizioni anidri e basse temperature. La reazione può essere espressa come segue:
SbF3 + 3HF + SO2F2 → HSbF6 + SO2
HSbF6 è un composto altamente reattivo e instabile che richiede una manipolazione e una conservazione speciali. Di solito viene conservato in contenitori sigillati e ermetici in condizioni anidre e a basse temperature per prevenire la decomposizione. Misure di sicurezza e dispositivi di protezione adeguati sono essenziali quando si lavora con HSbF6 a causa della sua elevata tossicità e corrosività.
Usi dell’acido fluoroantimonico
L’acido fluoroantimonico (HSbF6) è uno dei superacidi più potenti conosciuti e ha un’ampia gamma di applicazioni industriali e di ricerca. Ecco alcuni degli usi dell’acido fluoroantimonico:
- HSbF6 funge da catalizzatore in varie reazioni chimiche, comprese alchilazioni, isomeriche e polimerizzazioni.
- L’industria petrolchimica utilizza HSbF6 nella produzione di benzina ad alto numero di ottano e altri idrocarburi.
- I ricercatori dell’industria farmaceutica utilizzano HSbF6 come catalizzatore nella sintesi di vari prodotti farmaceutici, inclusi farmaci antivirali e antitumorali.
- HSbF6 trova applicazione nell’incisione e nella pulizia di componenti elettronici, come microchip e semiconduttori, utilizzati nella produzione di componenti elettronici.
- Gli scienziati utilizzano HSbF6 come strumento di ricerca in vari settori della chimica e della scienza dei materiali, compresa la sintesi di nuovi materiali e lo studio delle reazioni chimiche.
HSbF6 è una sostanza altamente reattiva e pericolosa che richiede una manipolazione specializzata e misure protettive. È strettamente regolamentato e deve essere utilizzato solo da personale addestrato in laboratori ben attrezzati. I potenziali pericoli associati a HSbF6 ne limitano l’uso ad applicazioni specializzate per le quali non sono disponibili altre alternative.
Domande:
L’acido fluoroantimonico può dissolvere il diamante?
HSbF6 può dissolvere il diamante grazie alle sue forti proprietà acide. Professionisti qualificati in laboratori ben attrezzati con adeguate misure di sicurezza e dispositivi di protezione possono eseguire la reazione molto pericolosa tra diamante e HSbF6. Tuttavia, non è un metodo pratico o economico per la lavorazione o il taglio dei diamanti. Il taglio meccanico o il taglio laser sono molto più comunemente utilizzati per la loro efficienza e sicurezza.
Dove acquistare l’acido fluoroantimonico?
L’acquisto di HSbF6 è estremamente difficile a causa della sua natura altamente pericolosa e regolamentata. Solo le aziende o le istituzioni approvate e autorizzate con i permessi e le attrezzature necessarie possono maneggiare e immagazzinare l’acido in modo sicuro.
La Convenzione sulle armi chimiche (CWC) e le normative statunitensi sugli standard antiterrorismo delle strutture chimiche (CFATS) classificano HSbF6 come una sostanza pericolosa e controllata.
Agenzie governative come l’Environmental Protection Agency (EPA), il Department of Homeland Security (DHS) e il Bureau of Industry and Security (BIS) regolano e controllano rigorosamente la vendita e l’acquisto di HSbF6.
Se hai un bisogno legittimo di HSbF6, puoi contattare fornitori chimici approvati o istituti di ricerca con i permessi e le competenze necessarie.
Tuttavia, è necessario fornire una giustificazione dettagliata e ottenere le approvazioni e i permessi necessari prima di effettuare qualsiasi acquisto.
