L’acido cromico è un agente ossidante forte e corrosivo utilizzato in una varietà di applicazioni, come la pulizia dei metalli, l’incisione e in alcuni esperimenti di laboratorio. È di colore rosso.
| Nome IUPAC | Acido cromico |
| Formula molecolare | H2CrO4 |
| numero CAS | 7738-94-5 |
| Sinonimi | Acido di cromo (VI), acido di cromo, diidrossidiossidocromo, diidrogeno (tetraossidocromato) |
| InChI | InChI=1S/Cr.H2O4/c;1-5(2,3)4/h;(H2,1,2,3,4)/q+2;/p-2 |
Proprietà dell’acido cromico
Formula dell’acido cromico
La formula chimica dell’acido di cromo è H2CrO4. È costituito da due atomi di idrogeno, un atomo di cromo e quattro atomi di ossigeno. La formula rappresenta la composizione dell’acido di cromo a livello molecolare.
Massa molare dell’acido cromico
La massa molare dell’acido di cromo può essere calcolata sommando le masse atomiche dei suoi elementi costitutivi. Il cromo ha una massa atomica di 51,996 grammi per mole, l’idrogeno ha una massa molare di 1,008 grammi per mole e l’ossigeno ha una massa molare di 16,00 grammi per mole. Pertanto, la massa molare dell’acido di cromo è di circa 118,00 grammi per mole.
Punto di ebollizione dell’acido cromico
L’acido di cromo non ha un punto di ebollizione distinto perché si decompone quando riscaldato, rilasciando gas ossigeno. Tuttavia, la sua temperatura di decomposizione è di circa 190°C (374°F). Quando riscaldato, l’acido di cromo subisce una reazione chimica che porta alla formazione di triossido di cromo e acqua.
Punto di fusione dell’acido cromico
Il punto di fusione dell’acido di cromo non è ben definito a causa della sua tendenza a decomporsi prima della fusione. Tuttavia, è noto che l’acido di cromo può decomporsi a circa 250°C (482°F) o anche a temperature inferiori, a seconda delle condizioni.
Densità dell’acido cromico g/mL
L’acido di cromo ha una densità di circa 1,2 grammi per millilitro (g/mL) a temperatura ambiente. Questo valore di densità indica che l’acido di cromo è relativamente denso rispetto all’acqua.
Peso molecolare dell’acido cromico
Il peso molecolare dell’acido di cromo viene calcolato sommando le masse atomiche dei suoi elementi costitutivi. In questo caso il peso molecolare è di circa 118,00 grammi per mole.
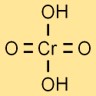
Struttura dell’acido cromico
La struttura dell’acido di cromo è rappresentata da un atomo di cromo centrale legato a quattro atomi di ossigeno e due atomi di idrogeno. Gli atomi di ossigeno sono disposti attorno all’atomo di cromo in una forma tetraedrica.
Solubilità dell’acido cromico
L’acido di cromo è moderatamente solubile in acqua, il che significa che può dissolversi in una certa misura. La solubilità aumenta con l’aumentare della temperatura. Tuttavia, deve essere maneggiato con cura poiché è una sostanza corrosiva.
| Aspetto | Cristalli rosso scuro |
| Peso specifico | 2,70 |
| Colore | Rosso |
| Odore | Inodore |
| Massa molare | 118,01 g/mole |
| Densità | 1.201 g/ml |
| Punto di fusione | Si decompone a ~190°C |
| Punto di ebollizione | Si decompone a ~250°C |
| Punto flash | Non applicabile |
| solubilità in acqua | Solubile |
| Solubilità | Solubile in acqua e solventi organici come etanolo, etere |
| Pressione del vapore | Non applicabile |
| Densità del vapore | Non applicabile |
| pKa | -0,64 |
| pH | Molto acido (pH < 1) |
Sicurezza e pericoli dell’acido cromico
L’acido di cromo comporta numerosi rischi per la sicurezza e deve essere maneggiato con cautela. È una sostanza corrosiva che, al contatto, può provocare gravi ustioni alla pelle, agli occhi e al sistema respiratorio. L’inalazione di vapori o nebbie di acido di cromo può irritare le vie respiratorie e causare tosse, mancanza di respiro e danni ai polmoni. È anche molto tossico se ingerito, causando dolore addominale, vomito e potenziali danni agli organi. Inoltre, l’acido di cromo è un forte agente ossidante e può reagire violentemente o incendiare sostanze infiammabili. Quando si lavora con l’acido di cromo è necessario indossare dispositivi di protezione adeguati, come guanti, occhiali protettivi e un camice da laboratorio, e devono essere conservati e smaltiti secondo le norme di sicurezza.
| Simboli di pericolo | Corrosivo, Ossidante |
| Descrizione della sicurezza | – Provoca gravi ustioni – Può incendio intenso; comburente – Nocivo se ingerito – Provoca irritazione delle vie respiratorie – Provoca danni agli occhi – Può provocare alterazioni genetiche – Può provocare il cancro – Può nuocere alla fertilità o al feto – Molto tossico per la vita acquatica – Maneggiare e smaltire correttamente |
| Numeri di identificazione delle Nazioni Unite | ONU1755, ONU1463 |
| Codice SA | 28191000 |
| Classe di pericolo | 8 (Corrosivo) |
| Gruppo di imballaggio | II (Intermedio) |
| Tossicità | Molto tossico e nocivo |
Metodi di sintesi dell’acido cromico
Esistono diversi metodi per sintetizzare l’acido di cromo.
Un metodo comune prevede la reazione tra bicromato di sodio (Na2Cr2O7) e acido solforico (H2SO4) . In questo processo, aggiungi lentamente il bicromato di sodio all’acido solforico mescolando. La reazione procede formando acido di cromo (H2CrO4) e solfato di sodio (Na2SO4) come sottoprodotto. La soluzione di acido di cromo risultante può essere purificata e concentrata rimuovendo l’acqua in eccesso.
Similmente al metodo precedente, possiamo aggiungere cromato di potassio all’acido solforico , determinando la formazione di acido di cromo e solfato di potassio (K2SO4) come sottoprodotto.
In alternativa, puoi preparare l’acido di cromo facendo reagire il triossido di cromo (CrO3) con acqua. Dissolvi il triossido di cromo in acqua, formando una soluzione di acido di cromo.
Ricordare che l’acido di cromo è una sostanza altamente corrosiva e pericolosa. Pertanto, la sua sintesi deve essere effettuata con adeguate precauzioni di sicurezza e in un’area ben ventilata. Indossare dispositivi di protezione, come guanti, occhiali e un camice da laboratorio, durante il processo di sintesi. Seguire inoltre metodi di smaltimento adeguati per garantire la manipolazione e lo smaltimento sicuri di eventuali rifiuti generati durante la sintesi.
Usi dell’acido cromico
L’acido di cromo trova varie applicazioni grazie alle sue proprietà di potente agente ossidante. Ecco alcuni usi comuni:
- Pulizia dei metalli: l’acido di cromo rimuove efficacemente ruggine, incrostazioni e depositi organici dalle superfici metalliche, pulendo e rimuovendo i contaminanti superficiali.
- Acquaforte: l’acido di cromo crea motivi e disegni raffinati su superfici come vetro, ceramica e metalli, incidendoli e rendendolo utile nella produzione di vetreria decorativa e nella fabbricazione di circuiti elettronici.
- Preparazione della superficie: i processi industriali utilizzano l’acido cromato per preparare le superfici alla verniciatura, al rivestimento o all’incollaggio, garantendo una buona adesione rimuovendo le impurità e creando una superficie pulita.
- Chimica analitica: chimici e laboratori utilizzano l’acido di cromo come agente ossidante nelle analisi chimiche e negli esperimenti di laboratorio, determinando le concentrazioni di alcuni composti organici.
- Conservazione del legno: l’acido di cromo agisce come conservante del legno, penetrando in profondità nelle fibre del legno per proteggerlo dalla putrefazione, dalle infestazioni di insetti e dagli agenti atmosferici.
- Industria tessile: l’industria tessile utilizza l’acido di cromo per i processi di tintura e stampa, fissando i coloranti nei tessuti e migliorando la solidità del colore.
- Fotografia: l’acido di cromo svolge un ruolo in alcuni processi fotografici, inclusa la produzione di stampe a colori e pellicole invertibili a colori.
- Galvanotecnica: nei processi di galvanica, in particolare per la cromatura, l’acido di cromo funge da fonte di ioni di cromo che si depositano sulle superfici metalliche, fornendo un rivestimento protettivo e decorativo.
È importante notare che l’acido di cromo è una sostanza pericolosa e devono essere prese adeguate precauzioni di sicurezza durante la sua manipolazione, conservazione e smaltimento.
Domande:
D: Cosa succede quando il fenolo viene ossidato con l’acido cromico?
R: Il fenolo subisce l’ossidazione con l’acido di cromo, con conseguente formazione di chinoni e acqua.
D: Come preparare l’acido cromico?
R: L’acido di cromo può essere preparato facendo reagire il dicromato di sodio o il cromato di potassio con acido solforico.
D: Come produrre l’acido cromico?
R: L’acido di cromo può essere prodotto mescolando un composto di cromo (come il triossido di cromo) con acqua.
D: Cos’è l’acido cromico?
R: L’acido di cromo è un agente ossidante forte e corrosivo composto da cromo, idrogeno e ossigeno.
D: L’acido cromico riduce gli alcheni?
R: No, l’acido di cromo è un agente ossidante e non ha proprietà riducenti.
D: Come preparare l’acido cromico per pulire la vetreria da laboratorio?
R: Una soluzione detergente a base di acido di cromo può essere prodotta sciogliendo il triossido di cromo in acqua e aggiungendo acido solforico.
D: L’acido cromico è un acido forte?
R: Sì, l’acido di cromo è considerato un acido forte grazie alla sua capacità di donare protoni.
D: Come preparo una soluzione detergente a base di acido cromico?
R: Per preparare una soluzione detergente a base di acido di cromo, sciogliere il triossido di cromo in acqua e aggiungere una piccola quantità di acido solforico.
D: Quale dei seguenti alcoli darà un test dell’acido cromico positivo?
R: Gli alcoli primari possono dare un test dell’acido cromo positivo, producendo un cambiamento di colore dall’arancione al verde o al blu.
