L’acido clorosolfonico è un acido forte con la formula HSO₃Cl. È molto corrosivo, utilizzato come reagente nella sintesi organica e come agente solfonante per la produzione di detersivi e coloranti.
| Nome dell’IUPAC | Acido clorosolfonico |
| Formula molecolare | HSO₃Cl |
| numero CAS | 7790-94-5 |
| Sinonimi | Cloridrina solforica, acido clorosolforico, acido clorosolfonico |
| InChI | InChI=1S/ClHO3S/c1-5(2,3)4/h(H,2,3,4) |
Proprietà dell’acido clorosolfonico
Formula dell’acido clorosolfonico
La formula dell’acido clorosolfonico è HSO₃Cl. È costituito da un atomo di idrogeno, un atomo di zolfo, tre atomi di ossigeno e un atomo di cloro.
Massa molare dell’acido clorosolfonico
La massa molare dell’acido clorosolforico si calcola sommando le masse atomiche dei suoi atomi costituenti. La massa molare di HSO₃Cl è di circa 116,5 grammi per mole.
Punto di ebollizione dell’acido clorosolfonico
Il punto di ebollizione dell’acido clorosolforico è relativamente alto. La temperatura è di circa 151 gradi Celsius (304 gradi Fahrenheit). A questa temperatura l’acido clorosolforico passa dalla fase liquida a quella gassosa.
Acido clorosolfonico Punto di fusione
L’acido clorosolforico ha un punto di fusione di circa -82 gradi Celsius (-116 gradi Fahrenheit). Questa è la temperatura alla quale la forma solida dell’acido clorosolforico si trasforma in un liquido.
Densità dell’acido clorosolfonico g/mL
L’acido clorosolforico ha una densità di circa 1,75 grammi per millilitro (g/mL) a temperatura ambiente. Ciò significa che un dato volume di acido clorosolforico è relativamente pesante rispetto ad un uguale volume di acqua.
Peso molecolare dell’acido clorosolfonico
Il peso molecolare dell’acido clorosolforico viene calcolato sommando i pesi atomici di tutti gli atomi nella sua formula chimica. L’acido clorosolforico ha un peso molecolare di circa 116,5 grammi per mole.
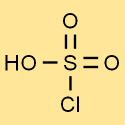
Struttura dell’acido clorosolfonico
La struttura dell’acido clorosolforico è costituita da un atomo di zolfo legato a tre atomi di ossigeno e un atomo di cloro. L’atomo di idrogeno è attaccato a uno degli atomi di ossigeno. Questa struttura conferisce all’acido clorosolforico le sue proprietà e reattività uniche.
Solubilità dell’acido clorosolfonico
L’acido clorosolforico è molto solubile in acqua. Si dissolve facilmente in acqua, formando una soluzione fortemente acida. La solubilità dell’acido clorosolforico è dovuta alla sua natura polare e alla formazione di legami idrogeno con le molecole d’acqua.
| Aspetto | Liquido da incolore a giallo |
| Peso specifico | 1,75 (a 20°C) |
| Colore | Da incolore a giallo |
| Odore | Odore forte e pungente |
| Massa molare | 116,5 g/mole |
| Densità | 1,75 g/ml (a 20°C) |
| Punto di fusione | -82°C (-116°F) |
| Punto di ebollizione | 151°C (304°F) |
| Punto flash | Non disponibile |
| solubilità in acqua | Miscibile |
| Solubilità | Solubile in solventi organici come cloroformio, diclorometano, nitrobenzene |
| Pressione del vapore | Non disponibile |
| Densità del vapore | Non disponibile |
| pKa | -2.6 |
| pH | Molto acido (pH < 1) |
Nota: tenere presente che i valori forniti in questa tabella sono proprietà generali associate all’acido clorosolforico. I valori effettivi possono variare leggermente a seconda delle condizioni specifiche e della purezza del composto.
Sicurezza e pericoli dell’acido clorosolfonico
L’acido clorosolforico presenta rischi significativi per la sicurezza e deve essere maneggiato con estrema cautela. È molto corrosivo e può provocare gravi ustioni a contatto con la pelle, gli occhi e le vie respiratorie. L’inalazione o l’ingestione possono causare gravi rischi per la salute, tra cui difficoltà respiratorie e danni agli organi interni. Reagisce violentemente con l’acqua, liberando gas tossici e generando calore. Esistono rischi di incendio ed esplosione a contatto con materiali organici. Quando si lavora con acido clorosolforico è necessario utilizzare dispositivi di protezione individuale adeguati, come guanti, occhiali e un respiratore. Un’adeguata ventilazione e misure di contenimento sono fondamentali per ridurre al minimo l’esposizione e garantire la sicurezza durante la manipolazione di questa sostanza pericolosa.
| Simboli di pericolo | Corrosivo (C), Nocivo (Xn) |
| Descrizione della sicurezza | – Maneggiare con estrema cautela\n- Utilizzare dispositivi di protezione adeguati\n- Evitare il contatto con la pelle, gli occhi e l’inalazione\n- Conservare in un’area ben ventilata\n- Non mescolare con acqua o sostanze reattive |
| Numeri di identificazione delle Nazioni Unite | ONU 1751 |
| Codice SA | 28121100 |
| Classe di pericolo | Classe 8 – Materie corrosive |
| Gruppo di imballaggio | Gruppo di imballaggio II |
| Tossicità | Molto tossico; provoca gravi ustioni e danni respiratori |
Metodi per la sintesi dell’acido clorosolfonico
Esistono diversi metodi per sintetizzare l’acido clorosolforico. Un metodo comune prevede la reazione tra triossido di zolfo (SO₃) e acido cloridrico (HCl) . In questo processo, la soluzione HCl viene fatta gorgogliare con gas SO₃ per generare acido clorosolforico. È necessario un attento controllo della temperatura e delle condizioni di reazione a causa dell’elevata esotermicità della reazione.
In un altro metodo, la reazione del cloro gassoso (Cl₂) con l’acido solforico (H₂SO₄) produce acido clorosolforico. Il passaggio del cloro gassoso attraverso l’acido solforico concentrato provoca la formazione di acido clorosolforico. Per garantire la sicurezza, è necessario adottare misure adeguate contro questa reazione esotermica.
Inoltre, la preparazione dell’acido clorosolforico prevede la reazione dell’acido solforico con cloruro di solforile (SO₂Cl₂). Il cloruro di solforile reagisce con l’acido solforico per formare acido clorosolforico e gas di acido cloridrico.
Va notato che la sintesi dell’acido clorosolforico deve essere effettuata in un laboratorio ben attrezzato, seguendo adeguati protocolli di sicurezza. Il farmacista deve utilizzare dispositivi di protezione, quali guanti, occhiali e cappuccio, per garantirne la sicurezza.
Questi metodi di sintesi consentono ai chimici di produrre acido clorosolforico, un composto versatile utilizzato in una varietà di applicazioni industriali, tra cui la sintesi organica, le reazioni di solfonazione e la produzione di coloranti e detergenti.
Usi dell’acido clorosolfonico
L’acido clorosolforico trova ampie applicazioni in vari settori grazie alle sue proprietà versatili. Ecco alcuni dei suoi usi:
- L’acido clorosolforico partecipa attivamente a varie reazioni di sintesi organica, comprese esterificazioni, solfonazioni e alogenazioni, fungendo da potente reagente. Introduce in modo efficiente gruppi funzionali e modifica le strutture molecolari.
- Nella produzione di coloranti, l’acido clorosolforico svolge un ruolo cruciale perché solfona attivamente i composti aromatici, consentendo la creazione di gruppi di acido solfonico. Questi gruppi migliorano la solubilità dei coloranti e migliorano le proprietà del colore.
- Nella produzione di detergenti, l’acido clorosolforico funziona attivamente come agente solfonante durante la sintesi dei composti detergenti. Contribuisce attivamente alla formazione dei tensioattivi, migliorandone le proprietà detergenti e schiumogene.
- L’industria farmaceutica utilizza ampiamente l’acido clorosolforico come componente attivo nella ricerca e nella produzione. Introduce attivamente gruppi sulfamidici nelle molecole dei farmaci, il che ha un impatto significativo sulle loro proprietà farmacologiche.
- Le reazioni di polimerizzazione utilizzano attivamente l’acido clorosolforico come catalizzatori o iniziatori per la sintesi di polimeri speciali. Questi polimeri stanno trovando attivamente applicazione in vari settori, come rivestimenti, adesivi e isolamento elettrico.
- Serve come importante intermedio nella produzione di vari prodotti chimici, inclusi acidi solfonici, esteri dell’acido solforico e clorosolfonati. Questi composti trovano applicazioni in vari settori come quello farmaceutico, agrochimico e nella produzione di polimeri.
- In laboratorio, i ricercatori utilizzano attivamente l’acido clorosolforico come reagente per varie reazioni chimiche, come reazioni di esterificazione, acilazione e disidratazione.
È importante maneggiare l’acido clorosolforico con cautela a causa della sua natura corrosiva e dei potenziali rischi per la salute.
Domande:
D: Come posso creare acetamidobenzenesulfonil cloruro da acetanilide e acido clorosolfonico?
R: L’acetamidobenzenesulfonil cloruro si forma trattando l’acetanilide con acido clorosolforico, con conseguente sostituzione del gruppo amminico con il gruppo solfonil cloruro.
D: Come utilizzare l’acido clorosolfonico?
R: L’acido clorosolforico viene utilizzato come reagente in varie reazioni chimiche, come solfonazione, esterificazione e acilazione, per introdurre gruppi funzionali o modificare strutture molecolari.
D: L’acido clorosolfonico è un buon gruppo uscente?
R: Sì, l’acido clorosolforico è un buon gruppo uscente grazie alla stabilità del gruppo dell’acido solfonico e alla sua capacità di subire reazioni di sostituzione.
D: Come rimuovere l’acido clorosolfonico?
R: L’acido clorosolforico deve essere neutralizzato con una base, come il carbonato di sodio, quindi diluito con acqua e smaltito con cura in conformità con le normative locali.
D: Cosa succede quando l’acido clorosolfonico entra in contatto con l’acqua?
R: Quando l’acido clorosolforico entra in contatto con l’acqua, reagisce vigorosamente, liberando calore e gas tossici, come l’anidride solforosa e l’acido cloridrico.
D: È possibile preparare il sodio lauril solfato sostituendo l’acido clorosolfonico con un altro reagente?
R: Sì, il sodio lauril solfato può essere sintetizzato sostituendo l’acido clorosolforico con acido solforico nella reazione con alcol laurilico, seguita dalla neutralizzazione con idrossido di sodio.
D: Qual è la densità dell’acido clorosolfonico?
R: La densità dell’acido clorosolforico è di circa 1,75 g/mL a temperatura ambiente.
D: Quante moli di acido clorosolfonico sono necessarie per produrre una mole di acetamidobenzenesulfonil cloruro?
R: Una mole di acetamidobenzenesulfonil cloruro può essere ottenuta facendo reagire una mole di acetanilide con una mole di acido clorosolforico.
D: L’acido clorosolfonico può essere conservato con ossidanti?
R: No, l’acido clorosolforico deve essere conservato separatamente dagli ossidanti, poiché può reagire violentemente o aumentare il rischio di incendio a contatto con sostanze ossidanti.
