L’acido carbonico (H2CO3) si forma quando l’anidride carbonica si dissolve nell’acqua e svolge un ruolo cruciale nella regolazione del pH dell’oceano e nel controllo dell’erosione delle rocce.
| Nome IUPAC | Acido carbonico |
| Formula molecolare | H2CO3 |
| numero CAS | 463-79-6 |
| Sinonimi | Aria acida; Aria acida; H2CO3; Ossidanioilidenmetano; Carbonato acido; idrossichetone; Diidrossimetanone |
| InChI | InChI=1S/CH2O3/c2-1(3)4/h(H2,2,3,4) |
Formula dell’acido carbonico
La formula chimica dell’acido carbonico è H2CO3, che indica che è composto da due atomi di idrogeno, un atomo di carbonio e tre atomi di ossigeno. La formula mostra anche il rapporto degli atomi nella molecola, che è importante per determinare la stechiometria delle reazioni chimiche che coinvolgono l’acido carbonico.
Massa molare dell’acido carbonico
La massa molare dell’acido carbonico è di circa 62,03 g/mol. È un acido debole che si forma quando l’anidride carbonica si dissolve nell’acqua ed è responsabile della regolazione del pH degli oceani. La massa molare dell’acido carbonico è importante per calcolare la quantità di acido necessaria per raggiungere un determinato pH in una soluzione e per determinare quanta anidride carbonica può dissolversi nell’acqua.
Punto di ebollizione dell’acido carbonico
L’acido carbonico non ha un punto di ebollizione ben definito, perché si scompone in acqua e anidride carbonica prima di raggiungere il punto di ebollizione. Tuttavia, a pressione atmosferica, l’acido carbonico si decompone ad una temperatura di circa 333 K (60 °C) in acqua e anidride carbonica.
Punto di fusione dell’acido carbonico
Anche l’acido carbonico non ha un punto di fusione ben definito, poiché si scompone in acqua e anidride carbonica prima di raggiungere il punto di fusione. Tuttavia, a pressione atmosferica, l’acido carbonico si decompone ad una temperatura di circa 273 K (-0,15 °C) in acqua e anidride carbonica.
Densità dell’acido carbonico g/ml
La densità dell’acido carbonico è di circa 1,67 g/mL a temperatura ambiente (25°C). Questo valore può variare a seconda della concentrazione della soluzione, nonché della temperatura e della pressione dell’ambiente.
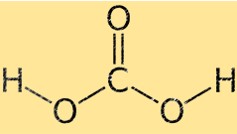
Struttura dell’acido carbonico
L’acido carbonico ha una geometria molecolare tetraedrica, con l’atomo di carbonio al centro e i quattro atomi circostanti (due di ossigeno e due di idrogeno) situati agli angoli di un tetraedro. I due atomi di ossigeno sono legati all’atomo di carbonio da doppi legami, mentre i due atomi di idrogeno sono legati da legami singoli.
Peso molecolare dell’acido carbonico
Il peso molecolare dell’acido carbonico è 62,03 g/mol. Questo valore viene calcolato sommando i pesi atomici degli elementi costituenti, che sono idrogeno (H), carbonio (C) e ossigeno (O).
| Aspetto | Liquido incolore o solido cristallino |
| Peso specifico | 1,67 g/cm³ |
| Colore | Incolore |
| Odore | Inodore |
| Massa molare | 62,03 g/mole |
| Densità | 1,67 g/ml a temperatura ambiente (25°C) |
| Punto di fusione | Si decompone a circa 273 K (-0,15 °C) |
| Punto di ebollizione | Si decompone a circa 333 K (60°C) |
| Punto flash | Non applicabile |
| solubilità in acqua | Completamente solubile |
| Solubilità | Solubile in acqua, etanolo, metanolo |
| Pressione del vapore | Non applicabile |
| Densità del vapore | Non applicabile |
| pKa | 3.6 (prima dissociazione) |
| pH | 5,6 (in soluzione 0,1 milioni) |
Acido carbonico Sicurezza e pericoli
L’acido carbonico (H2CO3) è generalmente considerato sicuro, ma può presentare alcuni pericoli in determinate situazioni. L’esposizione a H2CO3 può causare irritazione agli occhi, alla pelle e al sistema respiratorio e provocare tosse, respiro sibilante e mancanza di respiro. L’ingestione di H2CO3 può causare disturbi di stomaco, nausea e vomito. Anche l’H2CO3 è un acido debole e può reagire con alcuni metalli, come l’alluminio e lo zinco, per produrre gas idrogeno infiammabile. Quando si maneggia o si utilizza H2CO3, è necessario adottare adeguate precauzioni di sicurezza, compreso indossare indumenti protettivi e un’adeguata ventilazione. In caso di esposizione, è necessario consultare immediatamente un medico.
| Simboli di pericolo | Nessuno |
| Descrizione della sicurezza | Non tossico |
| Numeri di identificazione delle Nazioni Unite | Un 1824 |
| Codice SA | 28111990 |
| Classe di pericolo | 8 – Sostanze corrosive |
| Gruppo di imballaggio | III |
| Tossicità | Bassa tossicità |
Metodi di sintesi dell’acido carbonico
L’H2CO3 può essere sintetizzato con diversi metodi. Un metodo comune consiste nel far reagire l’anidride carbonica (CO2) con l’acqua (H2O) in presenza di un catalizzatore. Questo processo, chiamato idratazione, produce acido carbonico:
CO2 + H2O → H2CO3
Un altro metodo per sintetizzare l’acido carbonico prevede la reazione del carbonato di calcio (CaCO3) con un acido, come l’acido cloridrico (HCl). Questo processo, chiamato acidificazione, produce acido carbonico:
CaCO3 + 2HCl → CaCl2 + CO2 + H2O
La reazione tra l’acido ossalico e un carbonato, come il carbonato di sodio (Na2CO3), consente la sintesi dell’acido carbonico. Questo processo produce acido carbonico e un sale, come l’ossalato di sodio:
H2C2O4 + Na2CO3 → 2H2CO3 + Na2C2O4
Il processo Solvay produce acido carbonico e bicarbonato di sodio mediante la reazione del carbonato di sodio (Na2CO3) con l’anidride carbonica in presenza di acqua.
2NaHCO3 + CO2 → Na2CO3 + H2CO3
Nel complesso, sono disponibili diversi metodi per la sintesi dell’acido carbonico, ciascuno con i propri vantaggi e limiti. La scelta del metodo dipenderà da fattori quali la purezza desiderata del prodotto, la disponibilità delle materie prime e la scala di produzione richiesta.
Usi dell’acido carbonico
L’acido carbonico (H2CO3) è un composto versatile che trova molti usi nell’industria, nella medicina e nella vita di tutti i giorni. Alcuni degli usi principali di H2CO3 includono:
- Bevande gassate: H2CO3 è il composto responsabile del caratteristico effetto frizzante nelle bevande gassate come la soda e la birra.
- L’H2CO3 tampona il pH in vari processi industriali, come il trattamento delle acque e la lavorazione degli alimenti.
- Sopprime il fuoco spostando l’ossigeno e prevenendo la combustione.
- L’H2CO3 inibisce la crescita di batteri e muffe in alcuni tipi di prodotti alimentari per preservarli.
- Agisce come un detergente delicato, soprattutto per rimuovere i depositi minerali.
- Gli operatori sanitari utilizzano l’H2CO3 in determinate applicazioni, incluso il trattamento di alcune lesioni cutanee e l’induzione della costrizione bronchiale durante i test di funzionalità polmonare.
- I saldatori utilizzano H2CO3 come gas di protezione per prevenire l’ossidazione e produrre saldature più pulite.
Nel complesso, l’acido carbonico è un composto utile e versatile che ha una vasta gamma di applicazioni in vari campi.
Domande:
D: L’acido carbonico è un acido forte?
R: L’acido carbonico è un acido debole, il che significa che si dissocia solo parzialmente in acqua per produrre ioni idrogeno (H+) e ioni bicarbonato (HCO3-). La sua costante di dissociazione acida (Ka) è relativamente bassa, indicando che non si dissocia completamente in acqua.
D: L’anidride carbonica è acida?
R: L’anidride carbonica (CO2) non è intrinsecamente acida, poiché è un composto neutro che non produce ioni idrogeno (H+) nell’acqua. Tuttavia, quando la CO2 si dissolve in acqua, può reagire con le molecole d’acqua per formare acido carbonico, che è un acido debole. Questa reazione può far diminuire il pH, rendendo la soluzione più acida. Pertanto, anche se la CO2 di per sé non è acida, può contribuire all’acidità di una soluzione quando reagisce con l’acqua.
